题目内容
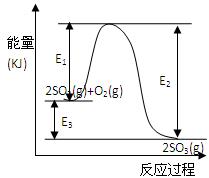
(9分)利用催化氧化反应将SO2转化为SO3是工业上生产硫酸的关键步骤。T℃时反应2SO2(g)+O2(g) 2SO3(g)过程中的能量变化如图所示,回答下列问题。
2SO3(g)过程中的能量变化如图所示,回答下列问题。
(1)T℃时将3mol SO2和1molO2通入体积为2L的恒温恒容密闭容器中,发生反应。2min时反应达到平衡,此时测得反应物O2还剩余0.1mol , 则达到平衡时SO2的转化率为 。(1分)
SO2和1molO2通入体积为2L的恒温恒容密闭容器中,发生反应。2min时反应达到平衡,此时测得反应物O2还剩余0.1mol , 则达到平衡时SO2的转化率为 。(1分)
(2)下列叙述能证明该反应已达化学平衡状态的是 (填序号)(2分)
①SO2的体积分数不再发生变化 ②容器内压强不再发生变化 ③容器内气体分子总数不再发生变化 ④相同时间内消耗2n molSO2的同时生成n molO2 ⑤相同时间内消耗2n molSO2的同时生成2n mol SO3
SO3
(3)反应 (填“放出”或“吸收”) 热量(用E1、E2或E3表示)(2分)。
(4)若以下图所示装置,用电化学原理生产硫酸,将SO2、O2以一定压强喷到活性电极上反应。
写出两电极的电极反应式:
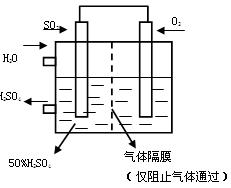
; 。(2分) [来网]为稳定持续生产,硫酸溶液的浓度应维持不变,则通入S O2和水的质量比为 (2分)
O2和水的质量比为 (2分)
 2SO3(g)过程中的能量变化如图所示,回答下列问题。
2SO3(g)过程中的能量变化如图所示,回答下列问题。(1)T℃时将3mol
 SO2和1molO2通入体积为2L的恒温恒容密闭容器中,发生反应。2min时反应达到平衡,此时测得反应物O2还剩余0.1mol , 则达到平衡时SO2的转化率为 。(1分)
SO2和1molO2通入体积为2L的恒温恒容密闭容器中,发生反应。2min时反应达到平衡,此时测得反应物O2还剩余0.1mol , 则达到平衡时SO2的转化率为 。(1分)
(2)下列叙述能证明该反应已达化学平衡状态的是 (填序号)(2分)
①SO2的体积分数不再发生变化 ②容器内压强不再发生变化 ③容器内气体分子总数不再发生变化 ④相同时间内消耗2n molSO2的同时生成n molO2 ⑤相同时间内消耗2n molSO2的同时生成2n mol
 SO3
SO3 (3)反应 (填“放出”或“吸收”) 热量(用E1、E2或E3表示)(2分)。
(4)若以下图所示装置,用电化学原理生产硫酸,将SO2、O2以一定压强喷到活性电极上反应。
写出两电极的电极反应式:

; 。(2分) [来网]为稳定持续生产,硫酸溶液的浓度应维持不变,则通入S
 O2和水的质量比为 (2分)
O2和水的质量比为 (2分)(1)60%(1分) (2)①②③④(2分)
(3)放热, E3或E2- E1、(2分)
(4)+:O2+4e-+4H+ 2H2O(1分)
2H2O(1分)
-:2SO2-4e-+4H2O 2SO42-+8H+(1分) 16: 29(2分)
2SO42-+8H+(1分) 16: 29(2分)
(3)放热, E3或E2- E1、(2分)
(4)+:O2+4e-+4H+
 2H2O(1分)
2H2O(1分)-:2SO2-4e-+4H2O
 2SO42-+8H+(1分) 16: 29(2分)
2SO42-+8H+(1分) 16: 29(2分)略

练习册系列答案
 一线名师提优试卷系列答案
一线名师提优试卷系列答案 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案
相关题目
 2C(g),平衡时C的体积分数与温度和压强的关系如图所示:
2C(g),平衡时C的体积分数与温度和压强的关系如图所示: 下
下 2AB3(g)在可变容器中不能作为达到平衡的标志是
2AB3(g)在可变容器中不能作为达到平衡的标志是 B(g),下列各项中,表示已达到平衡的是:
B(g),下列各项中,表示已达到平衡的是: 3Z(g)。下列说法不正确的是
3Z(g)。下列说法不正确的是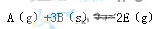 ,正反应放热。为使平衡状态向生成E的方向移动,适宜的条件是①高温、②低温、③高压、④低压、⑤加催化剂、⑥将E
,正反应放热。为使平衡状态向生成E的方向移动,适宜的条件是①高温、②低温、③高压、④低压、⑤加催化剂、⑥将E 2SO2(g)+O2(g) 平衡时,容器内有0.6 molSO2,其平衡常数约是
2SO2(g)+O2(g) 平衡时,容器内有0.6 molSO2,其平衡常数约是 6 H2O + 5N2,当各物质的浓度不随时间变化时,混合气体的体积为17L,则原混合气体中NO和 NH3的体积之比为
6 H2O + 5N2,当各物质的浓度不随时间变化时,混合气体的体积为17L,则原混合气体中NO和 NH3的体积之比为