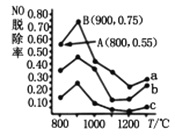
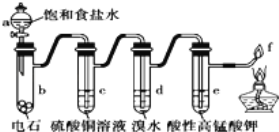
题目内容
【题目】用NA表示阿伏加德罗常数的值,下列叙述正确的是( )
A.含有NA个氦原子的氦气在标准状况下的体积约为11.2 L
B.物质的量浓度为0.5 mol/L的MgCl2溶液中含有NA个Cl-
C.标准状况下,11.2 L H2O含有的分子数为0.5 NA
D.在常温常压下,1.06 g Na2CO3含有的Na+数为0.02 NA
【答案】D
【解析】
A. 氦气为稀有气体,是单原子分子,含有NA个氦原子的氦气为1mol,在标准状况下的体积约为22.4 L,故A错误;
B. 物质的量浓度为0.5 mol/L的MgCl2溶液中未给出溶液的体积,不能计算溶液中溶质的物质的量,则氯离子的微粒数目无法计算,故B错误;
C. 标准状况下,11.2 L H2O为液体,不能用气体摩尔体积来计算物质的量,含有的分子数不等于0.5 NA
D. 1.06 g Na2CO3的物质的量为![]() =0.01mol,Na2CO3属于强电解质,溶液中完全电离,0.01molNa2CO3含有的Na+数为0.01mol ×2×NA mol-1=0.02 NA,故D正确;
=0.01mol,Na2CO3属于强电解质,溶液中完全电离,0.01molNa2CO3含有的Na+数为0.01mol ×2×NA mol-1=0.02 NA,故D正确;
答案选D。

 阅读快车系列答案
阅读快车系列答案【题目】现有四种溶液:A.盐酸B.稀硫酸C.NaOH溶液D.Ba(OH)2溶液。这些溶液溶质物质的量浓度均为0.3mol/L。根据溶液取用情况,判断得到的溶液中存在的主要离子及其浓度;或者根据最终离子的情况,推断最终溶液可能是哪些溶液按怎样的体积比混合的结果(忽略溶液混合后的体积变化)
溶液取用情况 | 溶液中存在的主要离子及其浓度 |
溶液A和B按体积比2:1混合 | ①____________ |
②____________ | Na+和Cl﹣物质的量浓度均为0.15 mol/L |
等体积混合溶液B和C | ③____________ |
溶液A和D按体积比2:1混合 | ④____________ |
⑤____________ | Ba2+物质的量浓度为0.1 mol/L,OH﹣物质的量浓度为0.2 mol/L |
【题目】乙酸乙酯是重要的有机合成中间体,广泛应用于化学工业。实验室制备乙酸乙酯的化学方程式:CH3COOH+C2H5OH![]() CH3COOC2H5+H2O,为证明浓硫酸在该反应中起到了催化剂和吸收剂的作用,某同学利用下图所示装置进行了以下四个实验,实验开始先用酒精灯微热3 min,再加热使之微微沸腾3min。实验结束后充分振荡试管Ⅱ再测有机层的厚度,实验记录如下:
CH3COOC2H5+H2O,为证明浓硫酸在该反应中起到了催化剂和吸收剂的作用,某同学利用下图所示装置进行了以下四个实验,实验开始先用酒精灯微热3 min,再加热使之微微沸腾3min。实验结束后充分振荡试管Ⅱ再测有机层的厚度,实验记录如下:
实验编号 | 试管Ⅰ中的试剂 | 试管Ⅱ中试剂 | 测得有机层的厚度/cm |
A | 2 mL乙醇、2 mL乙酸、1 mL 18 mol·L-1浓硫酸 | 饱和碳酸钠 溶液 | 5.0 |
B | 3 mL乙醇、2 mL乙酸 | 0.1 | |
C | 3 mL乙醇、2 mL乙酸、6mL 3 mol·L-1硫酸 | 1.2 | |
D | 3 mL乙醇、2 mL乙酸、盐酸 | 1.2 |
(1)实验D的目的是与实验C相对照,证明H+对酯化反应具有催化作用。实验D中应加入盐酸的体积和浓度分别是________mL和________mol/L。
(2)分析实验________(填实验编号)的数据,可以推测出浓硫酸的吸水性提高了乙酸乙酯的产率。浓硫酸的吸水性能够提高乙酸乙酯产率的原因是_____________________。
(3)加热有利于提高乙酸乙酯的产率,但实验发现温度过高乙酸乙酯的产率反而降低,可能的原因是______________(答出两条即可)。