题目内容
下表为元素周期表的一部分,请参照元素①~⑧在表中的位置,回答下列问题: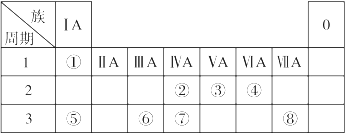
(1)在以上元素的原子中,原子半径最大的是 (填元素符号)。
(2)地壳中含量居于第二位的元素在周期表中的位置是 。
(3)①、④、⑤中的某些元素可形成既含离子键又含共价键的离子化合物,写出两种化合物的电子式 、 。
(4)W是第四周期与④同主族的元素。据此推测W不可能具有的性质是 。
| A.最高正化合价为+6价 | B.气态氢化物比H2S稳定 |
| C.最高价氧化物的水化物的酸性比硫酸弱 | D.单质在常温下可与氢气化合 |
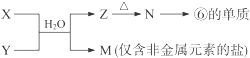
X溶液与Y溶液反应的离子方程式 ,
M中阳离子的鉴定方法 。
(1)Na (2)第三周期第ⅣA族
(3)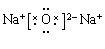 、
、  ;
; (4) B D
(4) B D
(5)Al3++3NH3·H2O=Al(OH)3↓+3NH4+(或Al3++3NH3+3H2O=Al(OH)3↓+3NH4+)
取少量M样品放入试管,加入氢氧化钠溶液后加热,产生能使湿润的红色石蕊试纸变蓝的气体,证明有铵根离子。
解析试题分析:(1)对于电子层数相同的元素来说,原子序数越大,原子半径越小;对于电子层数不同的元素来说,原子核外的电子层数越多,原子半径越大。所以在题目已知的元素中,原子半径最大的是Na. (2)地壳中含量居于第二位的元素Si在周期表中的位置是第三周期第ⅣA族。(3)①是H;④是O;⑤是Na.在这三种元素中的某些元素可形成既含离子键又含共价键的离子化合物,写出两种化合物的电子式为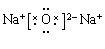 ;
; ;
; 。(4)第四周期第ⅥA的元素是Se,A.由于原子的最外层有6个电子,所以最高化合价为+6价;正确。B.同族元素从上到下,元素的非金属性逐渐减弱,所以气态氢化物的稳定性逐渐减弱。因此气态氢化物H2Se比H2S稳定差。错误。C.元素的非金属性越强,其最高价氧化物的水化物的酸性也越强。由于元素的非金属性S>Se。所以酸性H2SeO4比硫酸弱。正确。D.由于活动性S>Se,所以单质在常温下不能与氢气化合。错误。选项为BD。(5)由元素⑥、⑧形成的物质AlCl3与由元素①、③形成的化合物NH3在水中发生的反应为Al3++3NH3·H2O=Al(OH)3↓+3NH4+。M为NH4Cl。检验NH4+的方法是取少量M样品放入试管,加入氢氧化钠溶液后加热,产生能使湿润的红色石蕊试纸变蓝的气体,证明有铵根离子。
。(4)第四周期第ⅥA的元素是Se,A.由于原子的最外层有6个电子,所以最高化合价为+6价;正确。B.同族元素从上到下,元素的非金属性逐渐减弱,所以气态氢化物的稳定性逐渐减弱。因此气态氢化物H2Se比H2S稳定差。错误。C.元素的非金属性越强,其最高价氧化物的水化物的酸性也越强。由于元素的非金属性S>Se。所以酸性H2SeO4比硫酸弱。正确。D.由于活动性S>Se,所以单质在常温下不能与氢气化合。错误。选项为BD。(5)由元素⑥、⑧形成的物质AlCl3与由元素①、③形成的化合物NH3在水中发生的反应为Al3++3NH3·H2O=Al(OH)3↓+3NH4+。M为NH4Cl。检验NH4+的方法是取少量M样品放入试管,加入氢氧化钠溶液后加热,产生能使湿润的红色石蕊试纸变蓝的气体,证明有铵根离子。
考点:考查元素的推断、元素周期表、元素周期律的应用、离子的检验方法的知识。

(14分)下表列出了A—R九种元素在周期表中的位置,用元素符号或化学式填空。
 主族 主族周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | | | | E | | F | | |
| 3 | A | C | D | | | | G | R |
| 4 | B | | | | | | H | |
(2)D元素的最高价氧化物对应的水化物与氢氧化钠溶液反应的离子方程式是 。
(3)A、B、C三种元素按原子半径由大到小的顺序排列的为 。
(4)F的氢化物的电子式 ;G、H 氢化物的稳定性递减的顺序是 。
(5)H元素跟A元素形成的化合物的化学式是 ;A2F2的电子式是 ;。
(6)B和F两种元素形成的2:1型化合物属于 (填“离子化合物”或“共价化合物”),请用电子式表示其形成过程 。
(7)国际无机化学命名委员会在1989年作出决定, 把元素周期表的主、副族及其族号取消, 由左至右改为1~18列。按这个规定,第15列元素应为 族元素,其简单氢化物的化学式为 (用字母“M”表示该族元素)
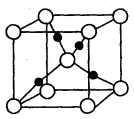
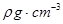 ,阿伏加德罗常数为
,阿伏加德罗常数为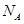 ,则晶胞边长为_______cm(用含
,则晶胞边长为_______cm(用含 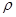 、
、
 ”或“
”或“ ”)。
”)。