题目内容
A、B、C、D四种元素,它们原子的核电荷数均小于18,且依次递增。A原子核内仅有1个质子,B原子的电子总数与D原子的最外层电子数相等,A原子与B原子的最外层电子数之和与C原子的最外层电子数相等,D原子的最外层电子数是次外层电子数的3倍。试推断它们各是什么元素,并写出其元素名称与符号。
A ;B ;C ;D 。
氢(H) 碳(C) 氮(N) 氧(O)
解析

练习册系列答案
 黎明文化寒假作业系列答案
黎明文化寒假作业系列答案
相关题目
下表为元素周期表的一部分,请参照元素①~⑧在表中的位置,回答下列问题: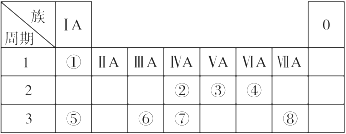
(1)在以上元素的原子中,原子半径最大的是 (填元素符号)。
(2)地壳中含量居于第二位的元素在周期表中的位置是 。
(3)①、④、⑤中的某些元素可形成既含离子键又含共价键的离子化合物,写出两种化合物的电子式 、 。
(4)W是第四周期与④同主族的元素。据此推测W不可能具有的性质是 。
| A.最高正化合价为+6价 | B.气态氢化物比H2S稳定 |
| C.最高价氧化物的水化物的酸性比硫酸弱 | D.单质在常温下可与氢气化合 |

X溶液与Y溶液反应的离子方程式 ,
M中阳离子的鉴定方法 。
四种短周期元素W、X、Y、Z,原子序数依次增大,请结合表中信息回答下列问题。
| | W | X | Y | Z |
| 结构或性质 | 最高价氧化物对应的水化物与其气态氢化物反应得到离子化合物 | 焰色反应呈黄色 | 在同周期主族元素形成的简单离子中,离子半径最小 | 最高正价与最低负价之和为零 |
(1)Z在元素周期表中位于 族。
(2)上述元素的最高价氧化物对应的水化物中,有一种物质在一定条件下均能与其他三种物质发生化学反应,该元素是 (填元素符号)。
(3)①下列可作为比较X和Y金属性强弱的依据是 (填序号)。
A.自然界中的含量 B.单质与酸反应时失去的电子数
C.单质与水反应的难易程度 D.最高价氧化物对应水化物的碱性
②从原子结构的角度解释X的金属性强于Y的原因: ,原子半径X>Y,所以原子核对最外层电子的吸引力X<Y,失电子能力X>Y。
(4)W的一种氢化物HW3可用于有机合成,其酸性与醋酸相似。体积和浓度均相等的HW3与X的最高价氧化物对应的水化物的溶液混合,反应的化学方程式是 。
(5)Y单质和Mg组成的混合物是一种焰火原料,某兴趣小组设计如下所示的实验方案,测定混合物中Y的质量分数。能确定混合物中Y的质量分数的数据有 (填序号)。
A.m、n B.m、y C.n、y

下表是元素周期表的一部分,请回答有关问题:
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | | | | ① | ② | | ③ | |
| 3 | | ④ | ⑤ | | | ⑥ | ⑦ | ⑧ |
| 4 | ⑨ | | | | | | ⑩ | |
(1)表中化学性质最不活泼的元素,其原子结构示意图为 。
(2)表中能形成两性氢氧化物的元素是 (用元素符号表示),写出该元素的单质与⑨最高价氧化物对应水化物反应的化学方程式 _______________________。
(3)设计实验方案:比较⑦与⑩单质氧化性的强弱,请将方案填入下表。
| 实验步骤 | 实验现象与结论 |
| | |
已知X、Y、Z为同一短周期的三种元素,其原子的部分电离能(kJ·mol-1)如下表所示:
| | X | Y | Z |
| I1 | 496 | 738 | 578 |
| I2 | 4562 | 1451 | 1817 |
| I3 | 6912 | 7733 | 2745 |
| I4 | 9543 | 10540 | 11575 |
(1)三种元素电负性大小关系为 。
(2)写出Y原子的电子排布式 ,Y的第一电离能大于Z的第一电离能的原因 。
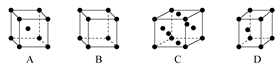
(3)X晶体采用下列 (填字母)堆积方式。
(4)含有元素X的盐的焰色反应为 色。许多金属盐都可以发生焰色反应,其原因是 。
(5)NaCl、KCl、MgO、CaO晶体结构相似,其中三种晶体的晶格能数据如下表:
| 晶体 | NaCl | KCl | CaO |
| 晶格能/(kJ·mol-1) | 786 | 715 | 3401 |
4种晶体NaCl、KCl、MgO、CaO熔点由高到低的顺序是 。