��Ŀ����
����Ŀ������㷺��������Ȼ����������ú�����֮�У������ʵ�����ȼ�ϣ����������������Ʒ����Ҫԭ�ϣ�
��1����ȡ����
��֪��CH4��g��+H2O��g��CO��g��+3H2��g����H=+206.2kJmol��1
CH4��g��+CO2��g��2CO��g��+2H2��g����H=+247.4kJmol��1
��i����д��CH4��g����H2O��g����Ӧ����CO2��g����H2��g�����Ȼ�ѧ����ʽ
��ii������0.1mol CH4��0.1mol H2O��g��ͨ�����Ϊ10L���ܱ��������һ�������·�����Ӧ��
CH4��g��+H2O��g��CO��g��+3H2��g����CH4��ƽ��ת�������¶ȡ�ѹǿ�Ĺ�ϵ��ͼ
����֪100��ʱ�ﵽƽ�������ʱ��Ϊ5min������H2��ʾ��ƽ����Ӧ����
�ڸ÷�Ӧ�Ļ�ѧƽ�ⳣ����
��ͼ�е�p1p2�����������������=������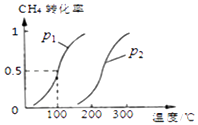
��2���Ʊ��״�
��ѹǿΪ0.1MPa�����£���a mol CO��3amol H2�Ļ�������ڴ������������Է���Ӧ���ɼ״���CO��g��+2H2��g��CH3OH��g����H��0���������ݻ����䣬���д�ʩ�����Ӽ״����ʵ���
A.�����¶�
B.�ٳ���1mol CO��3mol H2
C.��CH3OH��g������ϵ�з���
D.����He��ʹ��ϵ��ѹǿ����
E.ʹ�ø���Ч�Ĵ���
��3���ϳ�����
����ֱ�Ӻϳ����������Ҫ�����������Ӧ�ü�ֵ�������Ӧ����ʹ��CH4�����ѧʽ��ֱ�Ӻϳ����ᣬ�ҷ��ϡ���ɫ��ѧ����Ҫ��ԭ��������100%����
���𰸡�
��1��CH4��g��+2H2O��g���TCO2��g��+4H2��g����H=+165.0kmol��1��0.003mol/��L��min����6.75��10��4��mol/L��2����
��2��BC
��3��CO2
���������⣺��1����i����CH4��g��+H2O��g���TCO��g��+3H2��g����H=206.2kmol��1��CH4��g��+CO2��g���T2CO��g��+2H2��g����H=247.4kJmol��1
�ɸ�˹���ɣ��١�2���ڵã�CH4��g��+2H2O��g���TCO2��g��+4H2��g����H=+165.0kmol��1 ��
���Դ��ǣ�CH4��g��+2H2O��g���TCO2��g��+4H2��g����H=+165.0kmol��1����ii����1.0mol CH4��2.0mol H2O �� g ��ͨ���ݻ��̶�Ϊ10L�ķ�Ӧ�ң���һ�������·�����ӦI����ͼ���֪100�����ת����Ϊ50%���ʲμӷ�Ӧ�ļ���Ϊ1mol��50%=0.5mol����
CH4 ��g��+ | H2O ��g�� | = | CO ��g��+ | 3H2 ��g�� | |
��ʼ����mol���� | 1.0 | 2.0 | 0 | 0 | |
�仯����mol���� | 0.5 | 0.5 | 0.5 | 1.5 | |
ƽ������mol���� | 0.5 | 1.5 | 0.5 | 1.5 |
�ټ���100��ʱ�ﵽƽ�������ʱ��Ϊ5min������H2��ʾ�÷�Ӧ��ƽ����Ӧ����= ![]() =0.003 molL��1min��1 ��
=0.003 molL��1min��1 ��
���Դ��ǣ�0.0030molL��1min��1�� �ڸ÷�Ӧ�Ļ�ѧƽ�ⳣ��K= ![]() =
= 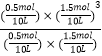 =6.75��10��4��mol/L��2 �� ���Դ��ǣ�6.75��10��4��mol/L��2����ͨ��ͼ����֪���¶���ͬʱ��p2��p1ʱ�������ת������ߣ�ƽ���������ƶ�������Ϊ����ϵ������ķ�Ӧ�����ݼ�Сѹǿƽ����ϵ������ķ����ƶ���֪��p1��p2 �� ���Դ��ǣ�������2��A���÷�Ӧ�Ƿ��ȵģ������¶ȣ�ƽ��������У����С�״����ʣ���A����
=6.75��10��4��mol/L��2 �� ���Դ��ǣ�6.75��10��4��mol/L��2����ͨ��ͼ����֪���¶���ͬʱ��p2��p1ʱ�������ת������ߣ�ƽ���������ƶ�������Ϊ����ϵ������ķ�Ӧ�����ݼ�Сѹǿƽ����ϵ������ķ����ƶ���֪��p1��p2 �� ���Դ��ǣ�������2��A���÷�Ӧ�Ƿ��ȵģ������¶ȣ�ƽ��������У����С�״����ʣ���A����
B���ٳ���1mol CO��3molH2 �� ����ѹǿ��ƽ�����ƣ�������״��IJ��ʣ���B��ȷ��
C����CH3OH��g������ϵ�з��룬���ʹƽ�������ƶ�����״��IJ��ʣ���C��ȷ��
D������He��ʹ��ϵ��ѹǿ����������䣬�����Ũ�Ȳ��䣬����ƽ�ⲻ���ƶ�������ı�״����ʣ���D����
E��ʹ�ô����ܸı䷴Ӧ���ʣ���ƽ�ⲻ�ƶ�����E����
��ѡBC����3�����üӳɷ�Ӧ����ʹԭ��������100%�����м��飨CH4������һ�ֻ�������ӳɷ�Ӧ����CH3COOH������ԭ���غ��֪��һ����ΪCO2 �� ���Դ��ǣ�CO2 ��

 ��У��������ĩ��̾�ϵ�д�
��У��������ĩ��̾�ϵ�д�



