��Ŀ����
����Ŀ��ij�����X��A12O3��Fe2O3��Cu��SiO2�е�һ�ֻ���������ɡ�
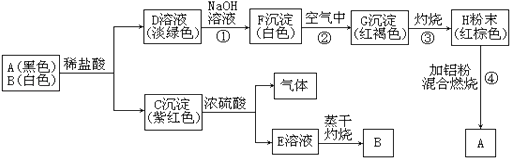
I.��������ʵ�飺

��ش�
��1������õ���ɫ��Һ���ù�����һ�������Ļ�ѧ��Ӧ�ǣ������ӷ���ʽ��ʾ��______��
��2����ӦII�Ļ�ѧ����ʽ��______________ ��X��һ�����е�������________��
II.Ϊ��һ��ȷ�����������X�ijɷ֣���ȡ9.4gX��������ʵ�顣

��3���������˲������ȱ��ϴ�Ӳ��裬��ʹ�òⶨ�Ĺ���������_______����ƫ��ƫС����Ӱ�죩
��4�������������ɫ��Һ��������Ϊ___________________��5��ԭ�������SiO2��������___________X��һ�������е�������_____________��
���𰸡� Fe2O3+6H+��2Fe3++3H2O��Cu+2Fe3+��2Fe2++Cu2+ SiO2+2NaOH��Na2SiO3+H2O Fe2O3 ��Cu ��SiO2 ƫ�� H�� Cu2�� Fe2�� 3.0g �����X����A12O3
��������9.4gX�������ᷴӦ������ɫ��Һ��˵����Ӧ����Һ�д���ͭ���ӣ����ǽ���Cu�������Ӧ������һ�������������������ᷴӦ���ɵ����������ӿ��Ժͽ���ͭ��Ӧ������������Ժ��������Ʒ�Ӧ��4.92g������������Ʒ�Ӧ��������������3.0g�����Ըù���Ϊ�������裬����Ϊ3.0g���漰�ķ�Ӧ�У�Fe2O3+6H+��2Fe3++3H2O��Cu+2Fe3+��2Fe2++Cu2+��SiO2+2NaOH��Na2SiO3+H2O������ΪCu��NaOH����Ӧ�����1.92g����ֻ��Cu������X��һ�����е�������Fe2O3��Cu��SiO2��9.4gX�����������������Һ��Ӧ��õ�6.4g�����������ٵ�������3.0g���������Ϸ�����֪����������3.0g������ԭ�����в�������������6.4g��������������ᷴӦ�õ���ɫ��Һ����ɫ��Һ�д���ͭ���ӣ������˷�Ӧ��Fe2O3+6H+��2Fe3++3H2O��Cu+2Fe3+��2Fe2++Cu2+��ʣ��1.92g����Ϊͭ��
��1��ͨ�����Ϸ�����֪�����õ���ɫ��Һ���ù�����һ�������Ļ�ѧ��Ӧ��Fe2O3+6H+��2Fe3++3H2O��Cu+2Fe3+��2Fe2++Cu2+����2��ͨ�����Ϸ�����֪��ӦII�Ļ�ѧ����ʽ��SiO2+2NaOH��Na2SiO3+H2O��X��һ�����е�������Fe2O3��Cu��SiO2����3��������������������������������˲������ȱ��ϴ�Ӳ��裬��ʹ�òⶨ�Ĺ���������ƫ������4����Ӧ�����������������������ɫ��Һ��������ΪH����Cu2����Fe2������5��ͨ�����Ϸ�����֪ԭ�������SiO2��������3.0g��X��һ�������е�������A12O3��