题目内容
设NA为阿伏加德罗常数,下列叙述中错误的是( )
| A、在标准状况下,22.4L空气中约有NA个气体分子 |
| B、在含4mol Si-O键的石英晶体中,氧原子的数目为2NA |
| C、28g乙烯和28g丙烯中均含有6NA对共用电子对 |
| D、含NA个氧原子的O2与含NA个氧原子的O3的质量之比为2:3 |
考点:阿伏加德罗常数
专题:阿伏加德罗常数和阿伏加德罗定律
分析:A.标准状况下,气体摩尔体积为22.4L/mol,22.4L空气中约含有1mol气体分子;
B.1mol二氧化硅中含有4硅氧键,据此计算出二氧化硅的物质的量及含有的氧原子数目;
C.乙烯和丙烯的最简式为CH2,烯烃分子中,每个C平均形成1个碳碳键、每个H平均形成1个碳氢键,根据最简式计算出28g乙烯和28个丙烯中含有的共用电子对;
D.氧气和臭氧都只含有氧原子,含NA个氧原子的O2与含NA个氧原子的O3的质量相等.
B.1mol二氧化硅中含有4硅氧键,据此计算出二氧化硅的物质的量及含有的氧原子数目;
C.乙烯和丙烯的最简式为CH2,烯烃分子中,每个C平均形成1个碳碳键、每个H平均形成1个碳氢键,根据最简式计算出28g乙烯和28个丙烯中含有的共用电子对;
D.氧气和臭氧都只含有氧原子,含NA个氧原子的O2与含NA个氧原子的O3的质量相等.
解答:
解:A.标准状况下,22.4L空气中越含有1mol气体分子,约有NA个气体分子,故A正确;
B.含4mol Si-O键的石英晶体中,二氧化硅的物质的量为1mol,1mol二氧化硅中含有2mol氧原子,氧原子的数目为2NA,故B正确;
C.28g乙烯和28g丙烯中都含有2mol最简式CH2,都含有2molC、4molH,在烯烃分子中,每个C平均形成1个碳碳键、每个H平均形成1个碳氢键,则28个乙烯和丙烯各自含有6mol共用电子对,均含有6NA对共用电子对,故C正确;
D.氧气和臭氧都只含有O原子,所以含NA个氧原子的O2与含NA个氧原子的O3的质量相等,质量之比为1:1,故D错误;
故选D.
B.含4mol Si-O键的石英晶体中,二氧化硅的物质的量为1mol,1mol二氧化硅中含有2mol氧原子,氧原子的数目为2NA,故B正确;
C.28g乙烯和28g丙烯中都含有2mol最简式CH2,都含有2molC、4molH,在烯烃分子中,每个C平均形成1个碳碳键、每个H平均形成1个碳氢键,则28个乙烯和丙烯各自含有6mol共用电子对,均含有6NA对共用电子对,故C正确;
D.氧气和臭氧都只含有O原子,所以含NA个氧原子的O2与含NA个氧原子的O3的质量相等,质量之比为1:1,故D错误;
故选D.
点评:本题考查了阿伏伽德罗常数的计算与判断,题目难度中等,注意掌握物质的量与阿伏伽德罗常数、摩尔质量之间的转化关系,明确二氧化硅中含有的硅氧键数目,选项D为易错点,氧气和臭氧中都的由氧元素构成.

练习册系列答案
相关题目
下列各组离子在指定溶液中肯定可以大量共存的是( )
| A、无色透明的溶液:Na+、I-、SO42-、Fe3+、K+、 | ||
B、
| ||
| C、加入Al能放出H2的溶液中:Mg2+、NH4+、Cl-、Na+、NO3- | ||
| D、常温下pH=1的溶液中:MnO4-、NO3-、SO42-、Na+、Fe2+ |
在某未知溶液中检验出含有Ba2+、NO3-,且溶液的pH=1.某学生还需鉴定此溶液中是否大量存在①Al3+ ②NH4+ ③Fe2+ ④Cl- ⑤AlO2- ⑥SO42- 其实这些离子中有一部分不必再鉴定就能加以否定,你认为不必再鉴定的离子组是( )
| A、③⑤⑥ | B、④⑤⑥ |
| C、①②⑤ | D、①③④ |
下列物质的说法正确的是( )
| A、芳香烃可以来自于煤干馏产品中的煤焦油 |
| B、聚氯乙烯可用于制作食品包装袋 |
| C、镀层破损后,白铁(镀锌的铁)比马口铁(镀锡的铁)更易腐蚀 |
| D、在铁的吸氧腐蚀中,负极是炭,电极反应为2H2O+O2+4e-=4OH- |
原电池反应是释放能量的氧化还原反应,下列可设计成原电池的化学反应是( )
| A、H2O (l)+CaO(s)═Ca(OH)2(s) | ||||
| B、Ba(OH)2?8H2O+2NH4Cl═BaCl2+2NH3?H2O+8H2O | ||||
C、2KClO3
| ||||
| D、CH4(g)+2O2(g)═CO2(g)+2H2O(l) |
下列化学用语正确的是( )
A、H2S的电子式: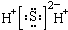 |
B、钙原子结构示意图: |
C、Na2O2的电子式: |
| D、铁离子:Fe2+ |
桂皮酸、布洛芬和阿司匹林均为某些药物的有效成分,其结构简式如下:
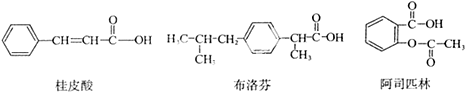
以下关于这三种有机物的说法中,不正确的是( )

以下关于这三种有机物的说法中,不正确的是( )
| A、都能与Na2CO3溶液反应产生CO2 |
| B、一定条件下,均能与乙醇发生取代反应 |
| C、只有桂皮酸可与溴的四氯化碳溶液发生加成反应 |
| D、1mol阿司匹林最多能与2mol NaOH反应 |