题目内容
原电池反应是释放能量的氧化还原反应,下列可设计成原电池的化学反应是( )
| A、H2O (l)+CaO(s)═Ca(OH)2(s) | ||||
| B、Ba(OH)2?8H2O+2NH4Cl═BaCl2+2NH3?H2O+8H2O | ||||
C、2KClO3
| ||||
| D、CH4(g)+2O2(g)═CO2(g)+2H2O(l) |
考点:设计原电池,原电池和电解池的工作原理
专题:电化学专题
分析:常温下能自动发生的氧化还原反应可设计成原电池,且为放热反应,以此来解答.
解答:
解:A.反应中没有元素的化合价变化,不属于氧化还原反应,不能设计成原电池,故A错误;
B.为吸热反应,且不是氧化还原反应,不能设计成原电池,故B错误;
C.为吸热反应,不能设计成原电池,故C错误;
D.C、O元素的化合价变化,为氧化还原反应,反应放热,可设计成原电池,故D正确.
故选D.
B.为吸热反应,且不是氧化还原反应,不能设计成原电池,故B错误;
C.为吸热反应,不能设计成原电池,故C错误;
D.C、O元素的化合价变化,为氧化还原反应,反应放热,可设计成原电池,故D正确.
故选D.
点评:本题考查原电池的设计,把握原电池反应与氧化还原反应的关系为解答的关键,注意常温下发生的氧化还原反应理论上可设计成原电池,题目难度不大.

练习册系列答案
 期末集结号系列答案
期末集结号系列答案
相关题目
设NA 表示阿伏加德罗常数的值.下列说法正确的是(已知相对原子质量H:1、O:16)( )
| A、0.1mol/L AlCl3溶液中Al3+浓度为0.1mol/L |
| B、常温常压下,18g H2O中含有的原子总数为3NA |
| C、1mol羟基中含有10NA个电子 |
| D、常温常压下,2.24L CO和CO2混合气体中含有的碳原子数目为0.1NA |
设NA为阿伏加德罗常数的数值,下列说法正确的是( )
| A、1mol Na与乙醇完全反应,失去2NA电子 |
| B、常温常压下,16g CH4含有10NA个电子 |
| C、1L 0.1mol?L-1的醋酸溶液中含有0.1NA个H+ |
| D、标准状况下,22.4L苯含有NA个苯分子 |
化学与工农业生产和人类生活密切相关.下列说法中,不正确的是( )
| A、油脂在碱性条件下水解可制得肥皂 |
| B、海轮外壳上镶入锌块,可减缓船体的腐蚀 |
| C、人体中缺碘元素会得贫血病 |
| D、研制推广甲醇燃料汽车,有利于“减排目标”的实现 |
25℃时,弱酸的电离平衡常数如表所示,下列说法正确的是( )
| 弱酸 | CH3COOH | HCN | H2CO3 |
| Ka | 1.8×10-5 | 4.9×10-10 | K1=4.3×10-7 K2=5.6×10-11 |
| A、等物质的量浓度溶液pH关系:pH(CH3COONa)<pH(NaHCO3)<pH(NaCN) |
| B、a mol?L-1 HCN与b mol?L-1 NaOH溶液等体积混合后溶液中c(Na+)>c(CN-),则a一定小于b |
| C、0.1mol?L-1的CH3COOH的 pH比0.1mol?L-1 HCN的pH大 |
| D、NaHCO3和Na2CO3的混合液中:c(Na+)+c(H+)=c(OH-)+c(HCO3-)+c(CO32-) |
设NA为阿伏加德罗常数,下列叙述中错误的是( )
| A、在标准状况下,22.4L空气中约有NA个气体分子 |
| B、在含4mol Si-O键的石英晶体中,氧原子的数目为2NA |
| C、28g乙烯和28g丙烯中均含有6NA对共用电子对 |
| D、含NA个氧原子的O2与含NA个氧原子的O3的质量之比为2:3 |
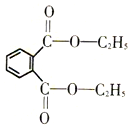 邻苯二甲酸酯类是一类能使塑料柔软的增塑剂,它可能影响胎儿和婴幼儿体内荷尔蒙分泌,引发激素失调,导致儿童性早熟,是可疑致癌物.下列关于邻苯二甲酸二乙酯(结构如图所示)的说法不正确的是( )
邻苯二甲酸酯类是一类能使塑料柔软的增塑剂,它可能影响胎儿和婴幼儿体内荷尔蒙分泌,引发激素失调,导致儿童性早熟,是可疑致癌物.下列关于邻苯二甲酸二乙酯(结构如图所示)的说法不正确的是( )| A、不溶于水,可溶于乙醇、醋酸等有机溶剂 |
| B、既能发生加成反应,也能发生取代反应 |
| C、1mol该物质恰好能与2mol NaOH完全反应 |
| D、0.1mol该物质充分燃烧需要标准状况的氧气32L |
某烷烃的结构简式为: ,下列命名正确的是( )
,下列命名正确的是( )
 ,下列命名正确的是( )
,下列命名正确的是( )| A、2,3-二甲基戊烷 |
| B、2-3-二甲基戊烷 |
| C、2-甲基-3-乙基戊烷 |
| D、2-乙基-3-甲基丁烷 |