题目内容
19.铁及其化合物在生活、生产中有广泛应用.请回答下列问题:(1)黄铁矿(主要成分为FeS2)是生产硫酸和冶炼钢铁的重要原料.高温下可发生反应:3FeS2+8O2$\frac{\underline{\;高温\;}}{\;}$6SO2+Fe3O4该过程中若有1.5mol FeS2参加反应,则反应过程中转移16mol电子.
(2)氯化铁溶液显酸性,原因是Fe3++3H2O?Fe(OH)3+3H+(离子方程式解释),用惰性电极电解氯化铁溶液之初,阳极电极反应式为:Cl--2e-=Cl2↑.
(3)K2FeO4可作为一种“绿色高效多功能”水处理剂.原因是:+6价的铁具有强氧化性可以杀菌消毒,其还原产物Fe3+水解生成氢氧化铁胶体净水.目前,人们针对K2FeO4的稳定性进行了大量的探索,并取得了一定的进展.下列物质中有可能提高化合物K2FeO4水溶液稳定性的是B
A.亚硫酸钠B.KOHC.醋酸D.Fe(NO3)3
(4)K2FeO4与Zn组成新型二次电池高铁电池,电解液为碱溶液,其反应式为:3Zn(OH)2+2Fe(OH)3+4KOH$?_{放电}^{充电}$3Zn+2K2FeO4+8H2O
放电时电池的负极反应式为Zn+2OH--2e-═Zn(OH)2;充电时电解液的pH减小(填“增大”“减小”或“不变”之一).
分析 (1)3FeS2+8O2$\frac{\underline{\;高温\;}}{\;}$6SO2+Fe3O4中,Fe、S元素的化合价升高,O元素的化合价降低;
(2)氯化铁溶液中,铁离子部分水解,溶液显示酸性;用惰性电极电解氯化铁溶液之初,阳极电极反应式为氯离子失电子放出氯气;
(3)K2FeO4中铁元素化合价为+6价,价态高,+6价的Fe元素易得电子表现出强氧化性,可杀菌消毒;还原产物Fe元素为+3价,在水中形成Fe(OH)3胶体,可吸附水中悬浮物并可使泥沙聚沉;在常温和干燥的条件下,化合物K2FeO4可以稳定的存在,但它在水溶液中不稳定等分析如何提高K2FeO4水溶液稳定性;
(4)Zn元素的化合价升高,放电时负极上Zn失去电子;由电池反应可知,充电时消耗KOH.
解答 解:(1)3FeS2+8O2$\frac{\underline{\;高温\;}}{\;}$6SO2+Fe3O4中,Fe、S元素的化合价升高,O元素的化合价降低,1.5molFeS2参加反应,则消耗氧气为4mol,由O元素的化合价变化可知,转移的电子为4mol×2×(2-0)=16mol,故答案为:16;
(2)氯化铁溶液中,铁离子结合水电离的氢氧根离子生成氢氧化铁,溶液中氢离子浓度大于氢氧根离子,溶液显示酸性,铁离子水解的方程式为:Fe3++3H2O?Fe(OH)3+3H+,用惰性电极电解氯化铁溶液之初,阳极电极反应式为氯离子失电子放出氯气,反应式为Cl--2e-=Cl2↑;
故答案为:Fe3++3H2O?Fe(OH)3+3H+;Cl--2e-=Cl2↑
(3)K2FeO4中铁元素化合价为+6价,价态高,易得电子,表现强氧化性,+6价的Fe元素易得电子表现出强氧化性,可杀菌消毒,还原产物Fe元素为+3价,在水中形成Fe(OH)3胶体,可吸附水中悬浮物并可使泥沙聚沉,
A.亚硫酸钠具有还原性,会被高铁酸钾氧化,故A错误;
B.高铁酸钾在碱性条件下生成,故B正确;
C.高铁酸钾在水溶液中不稳定,与酸反应,故C错误;
D.在常温和干燥的条件下,高铁酸钾可以稳定的存在,但它在水溶液中不稳定,故D错误;
故答案为:+6价的铁具有强氧化性可以杀菌消毒,其还原产物Fe3+水解生成氢氧化铁胶体净水;B;
(4)Zn元素的化合价升高,放电时负极上Zn失去电子,电极反应为Zn+2OH--2e-═Zn(OH)2,由电池反应可知,充电时消耗KOH,则pH减小,
故答案为:Zn+2OH--2e-═Zn(OH)2;减小.
点评 本题为小综合,涉及氧化还原反应、盐的水解反应及原电池原理,把握反应中元素的化合价变化及发生的氧化反应为解答的关键,注意原电池与氧化还原反应的关系,题目难度不大.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案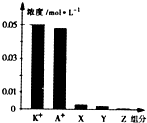 常温下,0.1mol•L-1一元酸HA与等浓度KOH溶液等体积混合后,所得溶液中部分微粒组分及浓度如图所示,下列说法正确的是( )
常温下,0.1mol•L-1一元酸HA与等浓度KOH溶液等体积混合后,所得溶液中部分微粒组分及浓度如图所示,下列说法正确的是( )| A. | 该混合溶液pH=7.0 | B. | 原HA溶液中:c(HA)>c(H+)>c(A-) | ||
| C. | 图中X表示HA,Y表示OH-,Z表示H+ | D. | 混合溶液中:c(X)+x(A-)=c(K+) |
 等质量的铁与过量的盐酸在不同的实验条件下进行反应,测定在不同时间t产生氢气体
等质量的铁与过量的盐酸在不同的实验条件下进行反应,测定在不同时间t产生氢气体积V的数据,根据数据绘制得到图,则曲线a、b、c、d所对应的实验组别可能是( )
| 组别 | c(HCl)/(mol•L-1) | 温度/(℃) | 状态 |
| 1 | 2.0 | 30 | 块状 |
| 2 | 2.5 | 30 | 块状 |
| 3 | 2.0 | 20 | 块状 |
| 4 | 2.5 | 30 | 粉末状 |
| A. | 4、3、2、1 | B. | 4、2、1、3 | C. | 3、4、2、1 | D. | 4、1、2、3 |
| A. | ①是非氧化还原反应,而②是氧化还原反应 | |
| B. | 上述反应中SO2的作用只相当于催化剂 | |
| C. | 反应②中CuSO4是氧化产物 | |
| D. | 反应①中SO2发生还原反应 |
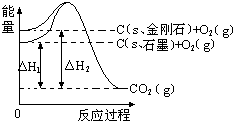
| A. | 金刚石比石墨稳定性好 | |
| B. | 石墨和金刚石的转化是物理变化 | |
| C. | C(s、石墨)=C(s、金刚石)△H=+1.9 kJ•mol-1 | |
| D. | 断裂1 mol石墨中的化学键吸收的能量比断裂1 mol金刚石中的化学键吸收的能量小1.9 kJ |
| 元素代号 | K | L | M | Q | R | T | N |
| 原子半径/nm | 0.183 | 0.160 | 0.143 | 0.102 | 0.089 | 0.074 | 0.152 |
| 主要化合价 | +1 | +2 | +3 | +6、-2 | +2 | -2 | +1 |
| A. | K、L、M三种元素的金属性逐渐减弱 | |
| B. | 在RCl2分子中,各原子均满足8电子的稳定结构 | |
| C. | Q元素的最高价氧化物为非电解质,其水溶液能够导电 | |
| D. | K在T单质中燃烧所形成的化合物中含有非极性共价键和离子键 |
 当今世界,能源的发展日益成为全世界、全人类共同关心的问题.
当今世界,能源的发展日益成为全世界、全人类共同关心的问题.(1)A和B的单质单位质量的燃烧热大,可用作燃料.已知A和B为短周期元素,其原子的第一至第四电离能如表所示:
| 电离能(kJ/mol) | I1 | I2 | I3 | I4 |
| A | 899 | 1 757 | 14 840 | 21 000 |
| B | 738 | 1 451 | 7 733 | 10 540 |
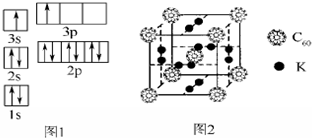
②某同学根据上述信息,推断B的核外电子排布如图1所示,该同学所画的电子排布图违背了能量最低原理.
(2)氢气作为一种清洁能源,必须解决它的储存问题,C60可用作储氢材料.
①已知金刚石中碳碳键的键长为154.45pm,C60中碳碳键的键长为145pm和140pm,有同学据此认为C60的熔点高于金刚石,你认为是否正确并阐述理由否或不正确,理由:C60是分子晶体,金刚石是原子晶体,熔化时C60破坏分子间作用力而金刚石破坏共价键,所以C60的沸点低于金刚石.
②科学家把C60和K掺杂在一起制造了一种富勒烯化合物,其晶胞如图2所示,该物质在低温时是一种超导体.该物质中K原子和C60分子的个数比为3:1.
③继C60后,科学家又合成Si60、N60,请比较C、Si、N原子电负性由大到小的顺序N>C>Si.Si60分子中每个硅原子只跟相邻的3个硅原子形成共价键,且每个硅原子最外层都满足8电子稳定结构,则一个Si60分子中所含π键的数目为30.
| 元素 | 有关信息 |
| A | 其氢化物水溶液呈碱性 |
| B | 地壳中含量最多的元素 |
| C | 单质须保存在煤油中 |
| D | 单质与NaOH溶液反应可用于生产漂白液 |
| E | 单质是生活中用量最大的金属,其制品在潮湿空气中易被腐蚀或损坏 |
(1)A的氢化物分子式是NH3,其水溶液能使酚酞变红的原因(用电离方程式解释)为:NH3•H2O?NH4++OH-;
(2)A、D的氢化物相互反应,产生大量白烟,该反应的方程式为:NH3+HCl=NH4Cl;
(3)A与B可组成质量比为7:16的三原子分子,该分子的化学式为NO2.
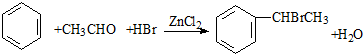 (卤烷基化反应)
(卤烷基化反应)
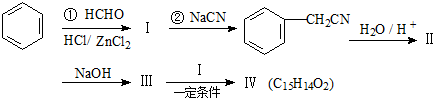
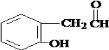 ,
,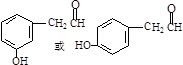 .
.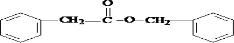 .
.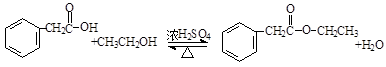 .
.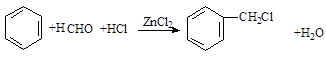 .
.