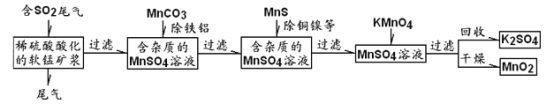
题目内容
【题目】把CO2和NO组成的混合气体80mL,缓缓通过足量的Na2O2,气体体积缩小为原混合气体的![]() ,则CO2和NO的体积比为( )
,则CO2和NO的体积比为( )
A.1:1B.2:3C.8:9D.9:2
【答案】AD
【解析】
发生反应有:①2Na2O2+2CO2═2Na2CO3+O2,②2NO+O2═2NO2
假设参加反应的CO2为x mL,NO为y mL,则x+y=80,
2CO2 +2Na2O2 =2Na2CO3 +O2…①
2mL 1mL
xmL ![]() mL
mL
2NO+O2=2NO2 ②
2mL 1mL 2mL
ymL ![]() mL
mL
(1)当反应②恰好反应时,即当y=x时(此时x、y都等于40),生成的NO2的体积为40mL,显然符合题意,所以选项A正确;
(2)当y>x时,NO有过量,O2反应完,此时反应掉的NO为xmL,则剩余的NO为(ymL﹣xmL),生成的NO2气体为xmL,因此,反应最后得到的混合气体为NO和NO2,其体积和为:(ymL﹣xmL)+xmL=ymL,结合x+y=80,再根据NO过量的前提条件:y>x,可以得出结论:y>40.这与题意“气体体积缩小为原混合气体的![]() ”不符,这种情况不可能符合题意,所以选项B和C错误;
”不符,这种情况不可能符合题意,所以选项B和C错误;
(3)当y<x时,NO不足,O2过量,此时反应掉的O2为![]() mL,剩余的O2为(
mL,剩余的O2为(![]() mL﹣
mL﹣![]() mL),生成的NO2气体为ymL.因此,反应最后得到的混合气体为O2和NO2,其体积和为:(
mL),生成的NO2气体为ymL.因此,反应最后得到的混合气体为O2和NO2,其体积和为:(![]() mL﹣
mL﹣![]() mL)+ymL=
mL)+ymL=![]() mL+
mL+![]() mL,这与题意“气体体积缩小为原混合气体的
mL,这与题意“气体体积缩小为原混合气体的![]() ”符合,这表明如果y<x,这种情况都能符合题意,所以选项D正确,
”符合,这表明如果y<x,这种情况都能符合题意,所以选项D正确,

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目