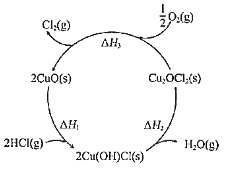
题目内容
【题目】为了探究三种气体(SO2、NO2、Cl2)的性质,某同学设计了两组实验:
(1)实验一:用三个集气瓶收集满二氧化硫、二氧化氮气体,然后将其倒置在水槽中。分别缓慢通入适量O2或Cl2,如图1所示。一段时间后,D、E装置的集气瓶中充满溶液,F装置的集气瓶中还有气体剩余。
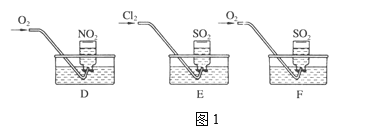
(假设瓶内液体不扩散):
①写出装置E中反应的离子方程式:____________________.
②假设该实验条件为标准状况,则装置D的集气瓶中所得溶液溶质的物质的量浓度为____________.
③通入氧气前在F装置的水槽里滴加几滴紫色石蕊溶液,观察到的现象是F装置集气瓶内溶液显浅红色,通入氧气后,可能观察到的实验现象是 _____________________________,写出反应的总化学方程式:________________.
(2)实验二:分别利用下图所示装置探究氯气的氧化性。
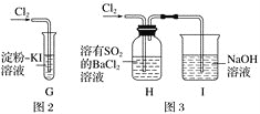
①G中的现象是_______________,原因是 ________________________(用化学方程式表示)。
②H中的现象是_________________________.
【答案】Cl2+SO2+2H2O=4H++2Cl-+SO42- 0.045mol·L-1 溶液红色加深 2SO2+O2+2H2O=2H2SO4 溶液由无色变为蓝色 Cl2+2KI=I2+2KCl 产生白色沉淀
【解析】
(1)根据氯气具有强氧化性,二氧化硫有还原性,两者发生氧化还原反应进行解答;(2)根据4NO2+O2+2H2O=4HNO3的反应特点,反应后液体能充满整个集气瓶,再根据浓度计算公式进行解答;(3)根据氯气具有强氧化性,能氧化I-和SO2气体进行分析。
(1)①E中二氧化硫和氯气反应生成硫酸和盐酸,其反应的离子方程式为:Cl2+SO2+2H2O=4H++2Cl-+SO42;
②D中二氧化氮、水、氧气反应生成硝酸,反应为4NO2+O2+2H2O=4HNO3,水会充满集气瓶,设集气瓶体积为VL,最后溶液的体积为VL,由4NO2+O2+2H2O=4HNO3 n(NO2)=n(HNO3),则所得溶液溶质的物质的量浓度为c=![]() =
=![]() L/mol=0.045mol·L-1;
L/mol=0.045mol·L-1;
(3)F装置中二氧化硫与水反应生成的亚硫酸溶液显酸性,滴加几滴紫色石蕊试液,观察到
的现象是紫色溶液变红,再通入氧气,发生2SO2+O+2H2O=2H2SO4,酸性增强,红色由浅变深;
(2)①G中是淀粉碘化钾溶液中通入Cl2,发生反应的化学方程式为:Cl2+2KI=I2+2KCl,生成的I2遇到淀粉变蓝;
②H中装有溶有二氧化硫的BaCl2的溶液,通入氯气后,二氧化硫被氧化为硫酸,遇到BaCl2的溶液会生成硫酸钡的白色沉淀。

 能考试期末冲刺卷系列答案
能考试期末冲刺卷系列答案