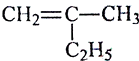题目内容
【题目】以下是以空气、海水中的物质为原料制取纯碱的工业流程:
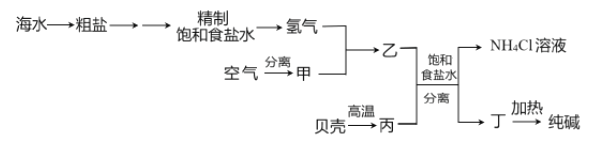
已知粗盐中含有Ca2+、Mg2+、SO42-等杂质离子。下列有关说法不正确的是
A. 除去粗盐中的杂质离子可依次加入NaOH溶液、BaCl2溶液、Na2CO3溶液
B. 甲、丙分别为N2、CO2
C. 分离得到丁和NH4Cl溶液的操作是过滤
D. 上述流程中物质转化有涉及置换反应
【答案】D
【解析】A. 在粗盐溶液中依次加入NaOH溶液、BaCl2溶液、Na2CO3溶液,可对应除去Mg2+、SO42-、Ca2+和过量的Ba2+,故A正确;B. 甲、丙分别为N2、CO2,故B正确;C. 丁是碳酸氢钠晶体,分离得到丁和NH4Cl溶液的操作是过滤,故C正确;D. 上述流程中物质转化没有涉及置换反应,故D不正确。故选D。

 智能训练练测考系列答案
智能训练练测考系列答案【题目】(Ⅰ)A、B、C为三种强电解质,它们在水中电离出的离子如下表所示:
阳离子 | Na+、K+、Cu2+ |
阴离子 | SO42-、OH- |
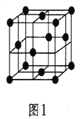
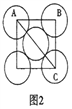
如图1所示装置中,甲、乙、丙三个烧杯中依次盛放足量的A溶液、足量的B溶液、足量的C溶液,电极均为石墨电极。接通电源,经过一段时间后,测得乙中c电极质量增加了32g。常温下各烧杯中溶液的pH与电解时间t的关系如图2所示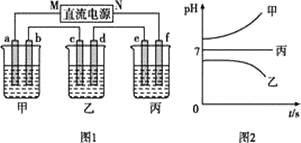
请回答下列问题:
(1)N为电源的(填“正”或“负”)极,电极b上发生的电极反应为。
(2)乙烧杯中的总反应为。
(3)计算电极e上生成的气体在标准状况下的体积为。
(4)丙烧杯要恢复到原来的状况,需要加入的物质和质量是。
(5)(Ⅱ)粗铜中一般含有锌、铁、银、金等杂质。在下图所示装置中,甲池的总反应方程式为:2CH3OH+3O2+4KOH═2K2CO3+6H2O 接通电路一段时间后,精Cu电极质量增加了3.2g。在此过程中,甲池负极反应式 , 乙池硫酸铜溶液的浓度(填“变大”,“ 不变”,“变小”)。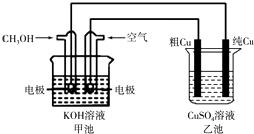
【题目】丙烯酸甲脂是—种重要的工业原料,某实验小组制取丙烯酸甲脂的装置如图所示: 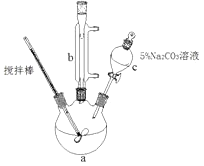
CH2=CHCOOH+HOCH3 ![]() CH2=CHCOOCH3+H2O
CH2=CHCOOCH3+H2O
①取10.0g丙烯酸和6.0g甲醇放置于三颈烧瓶中,连接好冷凝管,用搅拌棒搅拌,水浴加热。
②充分反应后,冷却,向混合液中加入5%Na2CO3溶液洗至中性。
③分液,取上层油状液体,再用无水Na2SO4干燥后蒸馏,收集70-90℃馏分。
可能用到的信息:
沸点 | 溶解性 | ||
丙烯酸 | 141℃ | 与水互溶,易溶于有机溶剂 | 有毒 |
甲醇 | 65℃ | 与水互溶,易溶于有机溶剂 | 易挥发,有毒 |
丙烯酸甲酯 | 80.5℃ | 难溶于水,易溶于有机溶剂 | 易挥发 |
回答下列问题:
(1)仪器b的名称是。
(2)混合液用5%Na2CO3溶液洗涤的目的是。
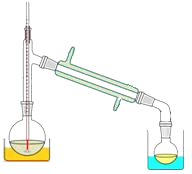
(3)关于产品的蒸馏操作(夹持装置未画出),下图中有2处错误,请分别写出、。![]()
![]()
为检验产率,设计如下实验:
①将油状物质提纯后平均分成5份,取出1份置于锥形瓶中,加入2.5mol/L的KOH溶液10.00mL,加热使之完全水解。
②用酚酞做指示剂,向冷却后的溶液中滴加0.5mol/L的HCl溶液,中和过量的KOH,滴到终点时共消耗盐酸18.00mL。
(4)计算本次酯化反应丙烯酸的转化率。
(5)请列举2条本实验中需要采取的安全防护措施、。
【题目】中华文化源远流长、博大精深。从化学的视角看,下列理解不正确的是
A | B | C | D |
千淘万漉虽辛苦,吹尽黄沙始到金。刘禹锡《浪淘沙》诗句 |
司母戊鼎 |
侯德榜 |
瓷器(China) |
诗句中“淘”“漉”相当于分离提纯操作中的“过滤”。 | 属青铜制品,是我国古代科技光辉成就的代表之一。 | 我国化学工业的奠基人,主要成就: 侯氏制碱法,该碱指的是烧碱。 | 属硅酸盐产品,China一词又指“瓷器”,这反映了在西方人眼中中国作为“瓷器故乡”的形象。 |
A. A B. B C. C D. D