题目内容
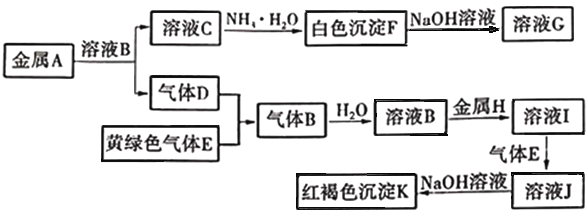
【题目】利用废旧镀锌铁皮可制备磁性Fe3O4胶体粒子及副产物ZnO,制备流程如下图所示
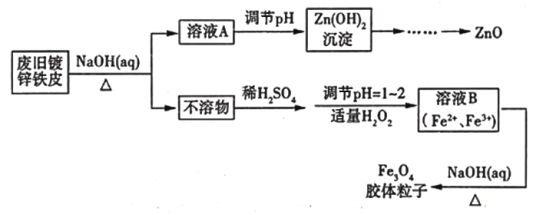
(1)从流程图可知,Zn、Fe中能与NaOH溶液反应的是_______________________。
(2)向不溶物中加入稀硫酸发生反应的离子方程式是____________________________________。
(3)加入适量H2O2的目的是__________________________________。
(4)如何证明已生成了Fe3O4胶体?_____________________________________________________。
(5)流程中所需的硫酸溶液由焦硫酸(H2SO4·SO3)溶于水配制而成,其中的SO3都转化为硫酸,若将445g焦硫酸溶于水配成4.00L硫酸,该硫酸的物质的量浓度为__________________mol/L。
(6)稀硫酸也可以用浓硫酸和水配制。已知4 mol/L的硫酸溶液密度为ρ1g/cm3,2 mol/L的硫酸溶液密度为ρ2g/cm3。100g物质的量浓度为4 mol/L的硫酸溶液与___________mL水混合,使硫酸的物质的量浓度减小到2 mol/L(用含ρ1、ρ2的式子表示)
【答案】Zn 2H++Fe=Fe2++H2↑ 做氧化剂,将部分Fe2+氧化为Fe3+ 利用丁达尔效应 1.25 ![]()
【解析】
废旧镀锌铁皮加入氢氧化钠溶液中反应,锌溶解生成偏锌酸钠和氢气,铁不溶解,过滤得到滤液A为Na2ZnO2,调节溶液PH生成氢氧化锌沉淀,过滤、洗涤、灼烧得到氧化锌,不溶物为铁,溶于稀硫酸加入适量过氧化氢,调节溶液PH=1~2,将部分亚铁离子氧化为铁离子,得到含Fe2+、Fe3+的B溶液,加热促进水解生成四氧化三铁胶体粒子。
(1)从流程图可以看出,锌能溶于氢氧化钠溶液,则加入氢氧化钠,锌发生反应,故答案为:Zn;
(2)不溶物为Fe,加入硫酸反应生成硫酸亚铁,反应的离子方程式为Fe+2H+=Fe2++H2↑,
故答案为:Fe+2H+=Fe2++H2↑;
(3)在酸性条件下,H2O2能将Fe2+氧化成Fe3+,反应的离子方程式为2Fe2++H2O2+2H+═2Fe3++2H2O,故答案为:做氧化剂,将部分Fe2+氧化为Fe3+;
(4)胶体具有丁达尔效应,可用丁达尔效应检验胶体的生成,故答案为:利用丁达尔效应;
(5)n(H2SO4)=2n(H2SO4SO3)=![]() ×2=5mol,所以该硫酸的物质的量浓度为c(H2SO4)=
×2=5mol,所以该硫酸的物质的量浓度为c(H2SO4)=![]() =1.25mol/L,故答案为:1.25;
=1.25mol/L,故答案为:1.25;
(6)设所需要水的体积为VmL,则稀释后溶液的浓度2mol/L=![]() =
=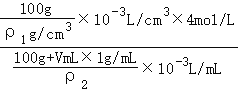 ,解得:V=
,解得:V=![]() mL,故答案为:
mL,故答案为:![]() 。
。

 期末100分闯关海淀考王系列答案
期末100分闯关海淀考王系列答案 小学能力测试卷系列答案
小学能力测试卷系列答案【题目】两份体积相同的某植物营养液,其配方分别如下:
KCl | K2SO4 | ZnSO4 | |
① | 0.3 mol·L-1 | 0.2 mol·L-1 | 0.1 mol·L-1 |
② | 0.1 mol·L-1 | 0.3 mol·L-1 | — |
下列对这两份营养液成分的分析中正确的是( )
A. K+的物质的量相同
B. Cl-的物质的量相同
C. 完全相同
D. SO![]() 的物质的量不同
的物质的量不同