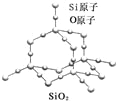
��Ŀ����
����Ŀ��ʵ���ǻ�ѧ�о�����Ҫ����֮һ��ijͬѧΪ���Ʊ�������̽�����������ʵ�������ʣ������ͼ��ʾ��ʵ�鷽����
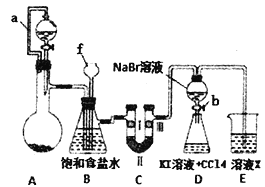
��1������f������___________��
��2��Aװ�õķ�Һ©����ʢװŨ���ᣬ��ƿ�����Ϊ�ظ����(K2Cr207)����ԭ������CrCl3��д��A�����ӷ���ʽ��________________________________��
��3��Bװ�õ����ó���������ȥ�����е��Ȼ������____________��
��4��װ��C��������̽���������Ե������Ƿ�һ����Ư���ԣ���������Լ������______________
������ţ�
�� | �� | �� | �� | |
I | ʪ��ĺ�ֽ�� | ����ĺ�ֽ�� | ����ĺ�ֽ�� | ʪ��ĺ�ֽ�� |
II | ��ʯ�� | Ũ���� | �轺 | �Ȼ��� |
II! | ����ĺ�ֽ�� | ����ĺ�ֽ�� | ����ĺ�ֽ�� | ����ĺ�ֽ�� |
��5������Dװ��֤����ķǽ����Աȵ�ǿ��ʵ������ǣ�ʵ����ϣ�_______������ƿ�������� _____________________________________________����������������ʵ�����������
��6��Dװ�ý���ʵ��ʱ���ڵ����Բ�����________________________________��
���𰸡� ����©�� Cr2O72-+l4H++6Cl-==2Cr3++3C12��+7H2O ����ȫƿ�����ʵ�������װ���Ƿ���� �� ����b��ʹ����Һ��������ƿ���رջ���b ���D�ֲ㣬�²�Һ����Ϻ�ɫ û���ų��������嵥����KI��Ӧ�ĸ���
����������1������f�����Ƴ���©�� ��(2)�ظ����(K2Cr207)��Ũ����������Cl2�� Cr2O72-+l4H++6Cl-==2Cr3++3C12��+7H2O ����3��װ��B���ǰ�ȫƿ�����ʵ�����ʱC���Ƿ�����������������ʱB�еģ�ѹǿ����B�г���©����Һ���������γ�ˮ������4����װ��C��ʵ��Ŀ������֤�����Ƿ����Ư���ԣ���֤�����Ƿ����Ư���ԣ�Ҫ��֤����������Ư���ԣ�ʪ�����ɫ�����У�������ˮ��Ӧ���ɴ��������Ư���ԣ�ѡ���Т٢ڢ۵Ģ��ж��Ǹ��������ͨ��ʪ�����ɫ����������֤������Ư���ԣ�����C��I��II��III���η���ʪ�����ɫ��������ˮ�Ȼ��ƣ��轺��P2O5�����������ɫ��������ѡ������5������Dװ��֤����ķǽ����Աȵ�ǿ��ʵ������ǣ�ʵ����ϴ���b��ʹ����Һ��������ƿ���رջ���b������ƿ�������� ���D�ֲ㣬�²�Һ����Ϻ�ɫ ����6��Dװ�ý���ʵ��ʱ���ڵ����Բ����� û���ų��������嵥����KI��Ӧ�ĸ��š�

 ��������ϵ�д�
��������ϵ�д� ��ӡ�Ļ���ʱ����ϵ�д�
��ӡ�Ļ���ʱ����ϵ�д� ��ѧ�����ϵ�д�
��ѧ�����ϵ�д�