题目内容
【题目】已建立化学平衡的可逆反应,改变条件使化学平衡向正反应方向移动,下列叙述中正确的是( )
A.生成物的产量一定增大 B.生成物的百分含量一定增大
C.反应物的浓度一定降低 D.每种反应物的转化率一定增大
【答案】A
【解析】A正确,平衡向正反应方向移动即生成物的量增多,生成物的产量一定增大;B错,如加入很多的反应物,平衡向正反应方向移动,但生成物的百分含量会减小;C错,如加入反应物,平衡虽向正反应方向移动,但加入的反应物的浓度则不会降低;D错,若对于两种反应物参加的反应,增加一种反应物的量,则另一种反应物的转化率增大,而本身的转化率减小;

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】实验是化学研究的重要方法之一,某同学为了制备氯气并探究氯气等物质的相关性质,设计如图所示的实验方案:
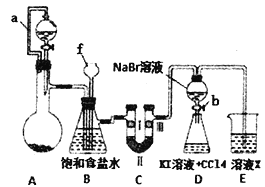
(1)仪器f的名称___________。
(2)A装置的分液漏斗里盛装浓盐酸,烧瓶里固体为重铬酸钾(K2Cr207),还原产物是CrCl3,写出A中离子方程式:________________________________。
(3)B装置的作用除了用来除去氯气中的氯化氢外还有____________。
(4)装置C的作用是探究有氧化性的物质是否一定有漂白性,下列最佳试剂组合是______________
(填序号)
① | ② | ③ | ④ | |
I | 湿润的红纸条 | 干燥的红纸条 | 干燥的红纸条 | 湿润的红纸条 |
II | 碱石灰 | 浓硫酸 | 硅胶 | 氯化钠 |
II! | 干燥的红纸条 | 干燥的红纸条 | 干燥的红纸条 | 干燥的红纸条 |
(5)利用D装置证明溴的非金属性比碘强的实验操作是:实验完毕,_______,振荡锥形瓶,现象是 _____________________________________________。(补充完整上述实验操作和现象)
(6)D装置进行实验时存在的明显不足是________________________________。