题目内容
13.下列离子方程式正确的是( )| A. | 钠与水反应:Na+2H2O═Na++2OH-+H2↑ | |
| B. | 0.01mol•L-1NH4Al(SO4)2溶液与0.02mol•L-1Ba(OH)2溶液等体积混合:NH4++Al3++2SO42-+2Ba2++4OH-═2BaSO4↓+Al(OH)3↓+NH3•H2O | |
| C. | 硅酸钠溶液与醋酸溶液混合:SiO32-+2H+═H2SiO3↓ | |
| D. | 浓硝酸中加入过量铁粉并加热:Fe+3NO3-+6H+═Fe3++3NO2↑+3H2O |
分析 A.离子方程式两边正电荷不相等,违反了电荷守恒;
B.溶液中NH4Al(SO4)2 与Ba(OH)2 以物质的量之比1:2混合,由于铵根离子结合氢氧根离子能力大于氢氧化铝,则反应生成氢氧化铝、硫酸钡和一水合氨;
C.醋酸为弱酸,离子方程式中醋酸不能拆开;
D.铁粉过量,反应生成亚铁离子.
解答 解:A.金属钠投入水中,反应生成氢氧化钠和氢气,正确的离子方程式为:2Na+2H2O=2Na++2OH-+H2↑,故A错误;
B.0.01mol•L-1NH4Al(SO4)2溶液与0.02mol•L-1Ba(OH)2溶液等体积混合,溶液中NH4Al(SO4)2与Ba(OH)2以物质的量之比为1:2,由于铵根离子结合氢氧根离子能力大于氢氧化铝反应生成氢氧化铝沉淀和一水合氨,反应的离子方程式为:NH4++Al3++2SO42-+2Ba2++4OH-═2BaSO4↓+Al(OH)3↓+NH3•H2O,故B正确;
C.硅酸钠溶液与醋酸溶液混合,醋酸应该保留分子式,正确的离子方程式为:SiO32-+2CH3COOH═H2SiO3↓+2CH3COO-,故C错误;
D.浓硝酸中加入过量铁粉并加热,反应生成硝酸亚铁,正确的离子方程式为:Fe+2NO3-+4H+═Fe2++2NO2↑+2H2O,故D错误;
故选B.
点评 本题考查了离子方程式的书写,题目难度中等,明确发生反应的实质及离子方程式的书写原则为解答关键,注意掌握判断离子方程式正误常用方法,B为易错点,需要明确铵根离子结合氢氧根离子能力大于氢氧化铝.

练习册系列答案
相关题目
3.自来水厂常用某些含铝或含铁的化合物作净水剂,它们能净水的原理是( )
| A. | 和水中的杂质反应,生成沉淀 | |
| B. | Al3+和Fe3+都有吸附杂质使之沉淀的能力 | |
| C. | 使杂质变成泡沫而除去 | |
| D. | 生成氢氧化铝、氢氧化铁胶体,吸附水中杂质使之沉淀 |
4.下列说法正确的是( )
| A. | 1 mol的 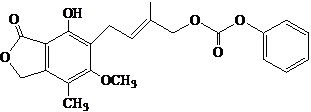 最多能与含5.0 mol NaOH的水溶液完全反应 最多能与含5.0 mol NaOH的水溶液完全反应 | |
| B. | 常压下,邻二甲苯、间二甲苯、对二甲苯的沸点依次增大 | |
| C. | 肌醇  与葡萄糖 与葡萄糖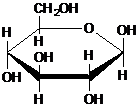 的元素组成相同,化学式均为C6H12O6,满足Cm(H2O)n,因此,均属于糖类化合物 的元素组成相同,化学式均为C6H12O6,满足Cm(H2O)n,因此,均属于糖类化合物 | |
| D. | C3H8的所有碳原子一定在同一平面上 |
1.下列对药品的有关叙述正确的是( )
| A. | 阿司匹林肠溶片具有较强的解热镇痛和抗炎、抗风湿效用,它能防止药物对胃的刺激 | |
| B. | “胃舒平”是抗酸药,主要用于治疗胃酸分泌过多的疾病,长期服用无任何副作用 | |
| C. | 青霉素是一种天然抗生素,对人体细胞的毒性很低,对病毒引起的疾病有良好的疗效 | |
| D. | 药物作用于人体,除了有治疗功效外,还可能引起不良反应,但不会危害人体健康 |
18.将一盛满Cl2的试管倒立在水槽中,当日光照射一段时间后,试管中气体颜色变成淡黄绿色,此时试管中的气体是( )
| A. | 只有O2 | B. | 只有Cl2 | C. | O2、Cl2 | D. | 无法判断 |
5.NA代表阿伏加德罗常数的数值,下列说法不正确的是( )
| A. | 标准状态下,22.4L O3含有分子的数目为NA | |
| B. | 常温常压下,4.0g CH4中含有共价键的数目为NA | |
| C. | 标准状态下,2.24L Cl2与足量NaOH溶液反应,转移电子数目为0.1NA | |
| D. | 常温下,1molNa2O2所含的阴阳离子总数为4NA |
4.下列各种物质既能与强酸反应又能与强碱反应的是( )
①Al ②AlCl3 ③Na[Al(OH)4]④Al(OH)3 ⑤Al2O3.
①Al ②AlCl3 ③Na[Al(OH)4]④Al(OH)3 ⑤Al2O3.
| A. | ①②③④⑤ | B. | ①③④⑤ | C. | ④⑤ | D. | ①④⑤ |
5.将1.12g铁粉加入25mL2mol•L-1的氯化铁溶液中,充分反应后,其结果是( )
| A. | 铁粉有剩余,溶液呈浅绿色,Cl-基本保持不变 | |
| B. | 往溶液中滴入无色KSCN溶液,溶液变红色 | |
| C. | Fe2+和Fe3+物质的量之比为5:1 | |
| D. | 氧化产物和还原产物的物质的量之比为2:5 |