题目内容
8.某学生设计氨催化氧化实验,并将制得的NO进一步氧化为NO2,用水吸收NO2,并检验HNO3的生成.可供选择的固体药品有:NH4Cl、Ca(OH)2、KClO3、MnO2、CaO.可供选择的液体药品有:H2O2、浓盐酸、水.可供选择的仪器有: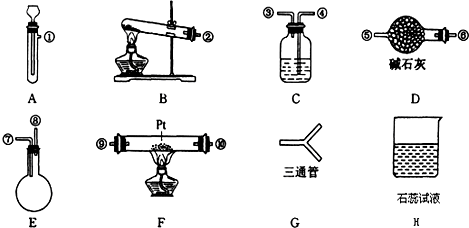
另有铁架台、铁夹、铁圈、乳胶管若干,可供选择.设计实验时,A和B两个制气装置均允许使用两次,其余装置只能使用一次.
(1)氨氧化制NO的化学反应应在装置F中进行.
(2)制取NH3的装置最好选择B,其化学反应方程式为2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$2NH3↑+CaCl2+2H2O;为快速制取O2的装置最好选择A,其化学反应方程式为2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑.
(3)各仪器按气流方向连接的正确顺序为:
A、B→G→D→F→C→E→H.(按装置先后排列顺序补充完整)
(4)装置C的作用是除去过量的NH3和生成的H2O.
( 5 ) 如果实验前需收集一试管的氨气,如何采用一种简易方法检验试管中
氨气是否集满(简述操作、现象和结论)?把湿润的红色石蕊贴在玻璃棒靠近试管口处,如果试纸变蓝色.说明氨气已收集满了
(6)装置H中溶液显红色,其原因是二氧化氮溶于水中生成了硝酸,硝酸使紫色石蕊试液变成红色
(7)请据以上实验事实设计一个实验来检验一份白色药品是铵盐,写出其正确的实验操作步骤取少量的该白色样品与碱混合后放入试管中共热,并把湿润的红色石蕊贴在玻璃棒靠近试管口处,如果试纸变蓝色,说明该白色样品就是氨盐.
分析 (1)氨气催化氧化制取一氧化氮,应在硬质试管内加热;
(2)实验室制取氨气用加热氯化铵、氢氧化钙混合物,依据反应物状态和反应条件选择发生装置;双氧水在二氧化锰催化作用下能迅速反应制取氧气,依据反应物状态和反应条件选择发生装置;
(3)制得的NH3和O2含有水蒸气,所以需要干燥,用碱石灰进行干燥,然后进入F发生成催化氧化,剩余的氨气需要用浓硫酸吸收,同时还要干燥NO,最后检验硝酸的生成,据此连接仪器;
(4)氨气与浓硫酸反应,可以用浓硫酸吸收过量的氨气和水蒸气;
(5)氨气为碱性气体,与水反应生成NH3•H2O,电离子出OH-离子,溶液呈碱性,可以利用湿润的红色石蕊试纸检验;
(6)能使石蕊显红色说明生成酸性物质;
(7)依据铵盐能够与碱反应生成氨气,氨气能使石蕊试纸变蓝,据此解答.
解答 解:(1)氨气催化氧化制取一氧化氮,应在硬质试管内加热,所以应选择装置F;
故答案为:F;
(2)实验室制取氨气用加热氯化铵、氢氧化钙混合物,反应的化学方程式:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$2NH3↑+CaCl2+2H2O,为状态为固体与固体加热,应选择装置B;
双氧水在二氧化锰催化作用下能迅速反应制取氧气,化学方程式:2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑,为固体与液体不加热,应选择装置A;
故答案为:B; 2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$2NH3↑+CaCl2+2H2O;A; 2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑
(3)制取代的NH3和O2含有水蒸气,所以需要干燥,用碱石灰进行干燥,然后进入F发生成催化氧化,剩余的氨气需要用浓硫酸吸收,同时还要干燥NO,最后检验硝酸的生成,所以正确的连接顺序是:A、B→G→D→F→C→E→H;
故答案为:DCE;
(4)C中装有浓硫酸用来吸收过来的氨气和水蒸气;
故答案为:除去过量的NH3和生成的H2O;
(5)氨气为碱性气体,与水反应生成NH3•H2O,电离子出OH-离子,溶液呈碱性,检验时可用湿润的红色石蕊试纸靠近试管口,如果试纸变蓝,说明氨气已收集满了;
故答案为:把湿润的红色石蕊贴在玻璃棒靠近试管口处,如果试纸变蓝色.说明氨气已收集满了;
(6)二氧化氮溶于水中生成了硝酸,硝酸使紫色石蕊试液变成红色,所以装置H中溶液显红色;
故答案为:二氧化氮溶于水中生成了硝酸,硝酸使紫色石蕊试液变成红色;
(7)铵盐能够与碱反应生成氨气,氨气能使石蕊试纸变蓝,所以其正确的实验操作步骤:取少量的该白色样品与碱混合后放入试管中共热,并把湿润的红色石蕊贴在玻璃棒靠近试管口处,如果试纸变蓝色,说明该白色样品就是氨盐;
故答案为:取少量的该白色样品与碱混合后放入试管中共热,并把湿润的红色石蕊贴在玻璃棒靠近试管口处,如果试纸变蓝色,说明该白色样品就是氨盐.
点评 本题考查了氨气的制备和性质的检验,明确氨气制备原理和性质是解题关键,注意氨气和铵盐的检验方法.

| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |
| A. | CO和CO2 | B. | NO和NO2 | C. | H2S和F2 | D. | CO2和SO2 |
| A. | 五氧化二磷只是磷酸的酸酐 | |
| B. | 二氧化氮不是硝酸的酸酐 | |
| C. | 安全火柴盒的侧面所涂的物质是一种混合物,其中含有红磷和三硫化二锑等 | |
| D. | 含磷的废水拍到自然水中,能引起藻类增殖,使水变质,必须除去 |
| A. | 钠与水反应:Na+2H2O═Na++2OH-+H2↑ | |
| B. | 0.01mol•L-1NH4Al(SO4)2溶液与0.02mol•L-1Ba(OH)2溶液等体积混合:NH4++Al3++2SO42-+2Ba2++4OH-═2BaSO4↓+Al(OH)3↓+NH3•H2O | |
| C. | 硅酸钠溶液与醋酸溶液混合:SiO32-+2H+═H2SiO3↓ | |
| D. | 浓硝酸中加入过量铁粉并加热:Fe+3NO3-+6H+═Fe3++3NO2↑+3H2O |
| A. | 常温常压下,22.4L H2O含有原子总数为3NA | |
| B. | 在标准状况下,22.4L Cl2和HCl的混合气体中含有的分子总数为2NA | |
| C. | 常温常压下,4.4g CO2与N2O的混合气体中含有的原子总数为0.3NA | |
| D. | NA个CO分子和0.5mol CH4 的质量比为7:4 |
| A. | 常温下向饱和AgCl水溶液中加入盐酸,Ksp值变大 | |
| B. | 在含有BaSO4沉淀的溶液中加入Na2SO4固体,c(Ba2+)增大 | |
| C. | 用稀盐酸洗涤AgCl沉淀比用水洗涤损耗AgCl小 | |
| D. | 物质的溶解度随温度的升高而增加,物质的溶解都是吸热的 |
 ;
; 2NH3
2NH3