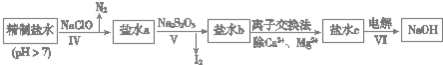
题目内容
3.自来水厂常用某些含铝或含铁的化合物作净水剂,它们能净水的原理是( )| A. | 和水中的杂质反应,生成沉淀 | |
| B. | Al3+和Fe3+都有吸附杂质使之沉淀的能力 | |
| C. | 使杂质变成泡沫而除去 | |
| D. | 生成氢氧化铝、氢氧化铁胶体,吸附水中杂质使之沉淀 |
分析 铝离子、铁离子水溶液中水解生成氢氧化铝、氢氧化铁胶体具有吸附悬浮杂质的作用,Al3+和Fe3+和水中的杂质不反应,也无吸附杂质使之沉淀的能力,无能力使变成泡沫而除去,据此分析解答.
解答 解:自来水厂常用某些含铝或含铁的化合物作净水剂,电离的铝离子、铁离子发生水解,Al3++3H2O?Al(OH)3(胶体)+3H+,Fe3++3H2O?Fe(OH)3(胶体)+3H+,生成的氢氧化铝胶体,氢氧化铁胶体具有较大的接触面积,具有吸附性,所以常用作净水剂,Al3+和Fe3+和水中的杂质不反应,也无吸附杂质使之沉淀的能力,无能力使变成泡沫而除去,故D正确,
故选D.
点评 本题考查了盐类水解的应用,明确“谁强谁显性、谁弱谁水解”及胶体的性质即可解答,题目难度不大.

练习册系列答案
相关题目
13.下列除去杂质的实验方法正确的是( )
| A. | 除去铜器表面的铜绿[Cu2(OH)2CO3]:用硝酸浸泡,再用清水冲洗 | |
| B. | 除去K2CO3固体中少量NaHCO3:置于坩埚中加热 | |
| C. | 除去KNO3晶体中少量NaCl:加水溶解、蒸发浓缩、冷却结晶、过滤洗涤 | |
| D. | 除去Mg(OH)2中少量的Ca(OH)2:加水,通入CO2 |
14.下列叙述正确的是( )‘
| A. | NH3是极性分子,N原子处在3个H原子所组成的三角形的中心 | |
| B. | CCl4性是非极性分子,C原子处在4个Cl原子所组成的正方形的中心 | |
| C. | H2O是极性分子,O原子不处在2个H原子所连成的直线的中央 | |
| D. | CO2是非极性分子,C原子不处在2个O原子所连成的直线的中央 |
11.有机化合物分子中原子间(或原子与原子团间)的相互影响会导致物质化学性质的不同.下列各项事实中,能说明上述观点的是( )
| A. | 甲醛和甲酸都能发生银镜反应 | |
| B. | 乙烯能发生加成反应,而乙烷不能发生加成反应 | |
| C. | 苯酚与溴水直接就可反应,而苯与溴反应则需要加铁屑 | |
| D. | 苯酚和乙酸都可以与氢氧化钠反应 |
8.下列物质间的反应,其能量变化符合如图的是( )


| A. | 氢气与氧气反应生成液态水 | |
| B. | 稀盐酸与金属镁反应 | |
| C. | 生石灰与稀盐酸反应 | |
| D. | 硫酸铵晶体与氢氧化钡晶体混合研磨而反应 |
15.短周期元素X、Y、Z的原子序数依次递增,其原子的最外层电子数之和为13.X与Y、Z位于相邻周期,Z原子最外层电子数是X原子内层电子数的3倍或者Y原子最外层电子数的3倍.下列说法正确是( )
| A. | X的氢化物溶于水显酸性 | |
| B. | Z位于周期表的第二周期VIA族 | |
| C. | X和Z的最高价氧化物对应的水化物都是弱酸 | |
| D. | Y的氧化物是离子化合物 |
13.下列离子方程式正确的是( )
| A. | 钠与水反应:Na+2H2O═Na++2OH-+H2↑ | |
| B. | 0.01mol•L-1NH4Al(SO4)2溶液与0.02mol•L-1Ba(OH)2溶液等体积混合:NH4++Al3++2SO42-+2Ba2++4OH-═2BaSO4↓+Al(OH)3↓+NH3•H2O | |
| C. | 硅酸钠溶液与醋酸溶液混合:SiO32-+2H+═H2SiO3↓ | |
| D. | 浓硝酸中加入过量铁粉并加热:Fe+3NO3-+6H+═Fe3++3NO2↑+3H2O |
 ;
; 2NH3
2NH3