题目内容
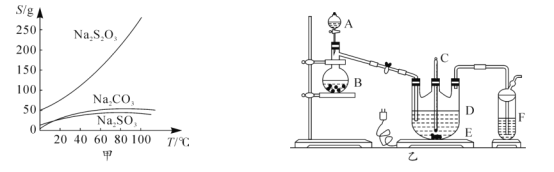
【题目】硫代硫酸钠俗称大苏打、海波,主要用作照相业定影剂,还广泛应用于鞣革、媒染、化工、医药等行业。常温下,溶液中析出晶体为Na2S2O35H2O.Na2S2O35H2O于40-45℃熔化,48℃分解;Na2S2O3易溶于水,不溶于乙醇。在水中有关物质的溶解度曲线如图甲所示。
Ⅰ.制备Na2S2O35H2O
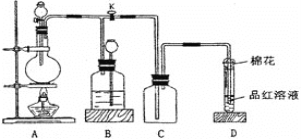
将硫化钠和碳酸钠按反应要求比例放入图乙装置D中,然后注入150mL蒸馏水使其溶解,再在分液漏斗A中注入一定浓度的H2SO4,在蒸馏烧瓶B中加入亚硫酸钠固体,并按图乙安装好装置。
(1)仪器D的名称为______
(2)打开分液漏斗活塞,注入H2SO4,使反应产生的气体较缓慢均匀地通入Na2S和Na2CO3的混合溶液中,并用磁力搅拌器搅动并加热,总反应方程式为2Na2S+Na2CO3+4SO2 ![]() 3Na2S2O3+CO2。
3Na2S2O3+CO2。
①烧瓶B中发生反应的化学方程式为______。
②将B中产生的气体缓慢均匀地通入D中的正确操作是______。
③制备过程中仪器D中的溶液要控制在弱碱性条件下,其理由是______(用离子方程式表示)。
Ⅱ.分离Na2S2O35H2O并测定含量

(3)操作I为趁热过滤,其目的是______;操作Ⅱ是过滤、洗涤、干燥,其中洗涤操作时用______(填试剂)作洗涤剂。
(4)蒸发浓缩滤液直至溶液中有少量晶体析出为止,蒸发时控制温度不宜过高的原因是______。
(5)制得的粗晶体中往往含有少量杂质。为了测定粗产品中Na2S2O35H2O的含量,称取1.25g的粗样品溶于水,配成250mL溶液,取25.00mL溶液于锥形瓶中,滴入几滴淀粉溶液,用0.0100mol/L标准I2溶液滴定,当溶液中S2O32-全部被氧化时,消耗碘溶液的体积为25.00mL.试回答:(提示:I2+2S2O32-═2I-+S4O62-)
①达到滴定终点时的现象:______
②产品中Na2S2O35H2O的质量分数为______。
【答案】三颈烧瓶 Na2SO3+H2SO4(浓)═Na2SO4+SO2↑+H2O 观察仪器D中气体的流速,控制分液漏斗A的旋塞,控制产生气体的速度 S2O32-+2H+═S↓+SO2↑+H2O 防止硫代硫酸钠晶体析出 乙醇 避免析出的晶体Na2S2O35H2O因温度过高而分解 滴加最后一滴标准I2溶液时溶液由无色变为蓝色且半分钟内不变色,说明到达滴定终点 99.2%
【解析】
(1)根据仪器的构造可知,仪器D的名称为三颈烧瓶,故答案为:三颈烧瓶;
(2)①亚硫酸钠与浓硫酸反应生成二氧化硫气体,反应的化学方程式为:Na2SO3+H2SO4(浓)=Na2SO4+SO2↑+H2O,故答案为:Na2SO3+H2SO4(浓)=Na2SO4+SO2↑+H2O;
②为将B中产生的气体缓慢均匀地通入D中,可以观察仪器D中气体的流速,通过控制分液漏斗A的旋塞,可控制产生气体的速度,故答案为:观察仪器D中气体的流速,控制分液漏斗A的旋塞,控制产生气体的速度;
③Na2S2O3在酸性条件下会生成S和SO2,所以制备过程中仪器D中的溶液要控制在弱碱性条件下以防止Na2S2O3发生歧化反应,其离子方程式为:S2O32-+2H+=S↓+SO2↑+H2O,故答案为:S2O32-+2H+=S↓+SO2↑+H2O;
(3)根据图甲可知,温度低时,硫代硫酸钠的溶解度小,会结晶析出,所以需要趁热过滤,防止硫代硫酸钠晶体析出;Na2S2O3易溶于水,不溶于乙醇,所以为防止洗涤损失硫代硫酸钠,应该用乙醇作洗涤剂,故答案为:防止硫代硫酸钠晶体析出;乙醇;
(4)Na2S2O35H2O于40-45℃熔化,48℃分解,所以蒸发时控制温度不宜过高的原因是避免析出的晶体Na2S2O35H2O因温度过高而分解,故答案为:避免析出的晶体Na2S2O35H2O因温度过高而分解;
(5)①碘遇淀粉变蓝色,反应结束时,溶液中S2O32-全部被氧化时,滴加最后一滴标准I2溶液时溶液由无色变为蓝色且半分钟内不变色,说明到达滴定终点,故答案为:滴加最后一滴标准I2溶液时,溶液由无色变为蓝色且半分钟内不变色,说明到达滴定终点;
②根据碘与硫代硫酸钠的反应I2+2S2O32-═2I-+S4O62-中的比例关系,配成的溶液中 c(S2O32-)= ![]() =
= ![]() =0.02mol/L,则产品中Na2S2O35H2O的质量分数=
=0.02mol/L,则产品中Na2S2O35H2O的质量分数=![]() =99.2%,故答案为:99.2%。
=99.2%,故答案为:99.2%。