题目内容
2.S2O在碱性条件下发生的歧化反应如下:S2O+NaOH→Na2S+Na2S2O4+Na2SO3+H2O.该反应包含两个独立的歧化反应,它们的化学方程式为①:5S2O+14NaOH=4Na2S+3Na2S2O4+7H2O,②:2S2O+8NaOH=2Na2S+2Na2SO3+4H2O.如果这两个独立的歧化反应S2O是等物质的量发生的,则按上述S2O的总歧化反应的配平的化学方程式为10S2O+34NaOH=9Na2S+3Na2S2O4+5Na2SO3+17H2O.
分析 S2O在NaOH溶液中发生两种歧化反应,生成S2-、S2O42-、SO32-,结合电子、电荷守恒书写离子反应.
解答 S2O在NaOH溶液中发生两种歧化反应,生成S2-、S2O42-、SO32-,由电子、电荷守恒可知,硫元素化合价+1价变化为-2价和+6价,-1价硫元素变化为-2价和+4价发生歧化反应,反应离子反应为:5S2O+14NaOH=4Na2S+3Na2S2O4+7H2O,2S2O+8NaOH=2Na2S+2Na2SO3+4H2O,如果这两个独立的歧化反应S2O是等物质的量发生的,结合上述两个化学方程式合并书写,则按上述S2O的总歧化反应的配平的化学方程式为:10S2O+34NaOH=9Na2S+3Na2S2O4+5Na2SO3+17H2O,
故答案为:5S2O+14NaOH=4Na2S+3Na2S2O4+7H2O,2S2O+8NaOH=2Na2S+2Na2SO3+4H2O,10S2O+34NaOH=9Na2S+3Na2S2O4+5Na2SO3+17H2O.
点评 本题考查了物质发生氧化还原反应的分析,主要是歧化反应的产物分析和化学方程式的书写方法和配平,掌握基础是关键,题目难度中等.

练习册系列答案
相关题目
10.分类是重要的科学研究方法,下列物质归类正确的是( )
| A. | 碱:苛性碱、纯碱、火碱 | |
| B. | 碱性氧化物:氧化铜、氧化铁、七氧化二锰、二氧化硅 | |
| C. | 混合物:水煤气、矿泉水、盐酸 | |
| D. | 无丁达尔现象的分散系:氯化铁溶液、碘的四氯化碳溶液、蒸馏水 |
17.设NA为阿伏伽德罗常数的值,下列叙述正确的是( )
| A. | 100mL 0.1mol/L K2SO4溶液中,含有氧原子数为0.04NA | |
| B. | 标准状况下,2.24L氯气溶于水发生反应,转移电子数目为0.1NA | |
| C. | 1mol Na与足量O2反应生成Na2O和Na2O2的混合物,转移的电子数为NA | |
| D. | 25℃时,1.0L pH=13的Ba(OH)2溶液中,含有0.2NAOH- |
7.X,Y,Z,W为原子序数依次增大的四种短周期元素,它们分别处在两个周期,Y和W同主族,化合物ZW2的水溶液显酸性,X和Z可疑构成离子化合物ZX,下列说法错误的是( )
| A. | 离子半径:X2->Y->Z2+ | |
| B. | 单质的熔点:Z>W>Y | |
| C. | 能破坏水的电离平衡的离子为:Y-,Z2+,W- | |
| D. | 离子化合物ZX的熔点高,ZX可作为耐火材料 |
7.下列各组物质互为同分异构体的是( )
| A. | CH4和CH3-CH2-CH3 | B. | C2H5-OH和C6H5-OH | ||
| C. | CH3-CH2-CH2-CH3和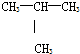 | D. | C2H4和C3H4 |
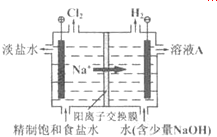 生产生活中广泛涉及氧化还原反应.
生产生活中广泛涉及氧化还原反应.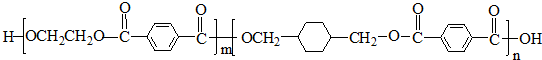
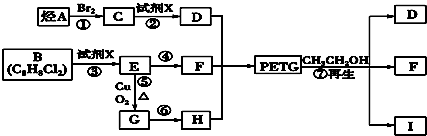
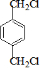 、I
、I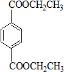 .
.
 .
. 回答下列问题.
回答下列问题.