题目内容
4.下列说法正确的是( )| A. | 将少量的溴水滴入FeCl2、NaI的混合溶液中,再滴加CCl4,振荡、静置,下层溶液呈紫红色,说明氧化性:Br2>Fe3+>I2 | |
| B. | 已知NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l)△H=-57.3 kJ•mol-1,则含40.0 g NaOH的稀溶液与稀醋酸完全中和,放出57.3 kJ的热量 | |
| C. | 常温下,0.1 mol•L-1某一元酸HA溶液中$\frac{c(O{H}^{-})}{c({H}^{+})}$=1×10-12,溶液中加入一定量NaA晶体或加水稀释,溶液中c(OH-)均增大 | |
| D. | 取久置的Na2O2粉末,向其中滴加过量的盐酸,产生无色气体,不能说明Na2O2是否变质 |
分析 A.同一自发进行的氧化还原反应中,氧化剂的氧化性大于氧化产物的氧化性,据此判断氧化性强弱;
B.醋酸为弱电解质,电离过程吸收热量;
C.0.1 mol•L-1某一元酸HA溶液中$\frac{c(O{H}^{-})}{c({H}^{+})}$=1×10-12,可知该一元酸为强酸;
D.过氧化钠与盐酸反应生成无色的气体氧气.
解答 解:A.将少量的溴水滴入FeCl2、NaI的混合溶液中,再滴加CCl4,振荡、静置,下层溶液呈紫红色,说明碘离子别氧化为碘单质,能够说明溴的氧化性强于碘,根据已知现象不能确定三价铁离子与溴、碘的氧化性,故A错误;
B.醋酸为弱电解质,电离过程吸收热量,所以则含40.0 g NaOH的稀溶液与稀醋酸完全中和,放出小于57.3 kJ的热量,故B错误;
C.0.1 mol•L-1某一元酸HA溶液中$\frac{c(O{H}^{-})}{c({H}^{+})}$=1×10-12,可知该一元酸为强酸,不存在电离平衡,加入一定量NaA晶体,不会影响溶液中氢离子、氢氧根离子的浓度,故C错误;
D.过氧化钠、碳酸钠都能分别与盐酸反应生成无色的气体氧气和二氧化碳,所以,不能说明过氧化钠是否变质,故D正确;
故选:D.
点评 本题考查较综合,涉及氧化性强弱的判断、中和热的计算、弱电解质电离平衡影响因素、过氧化钠的性质,题目综合性强,难度中等,注意对相关知识的应用.

练习册系列答案
相关题目
14.用下列装置进行相应实验,能达到实验目的是( )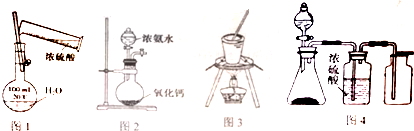

| A. | 用图1所示配制一定浓度的稀硫酸 | B. | 用图2装置实验室制取氨气 | ||
| C. | 用图3装置蒸发饱和食盐水 | D. | 用图4装置制取、收集乙炔气体 |
15. 常温下,将Cl2缓慢通入水中至饱和,然后向所得饱和氯水中滴加0.1mol•L-1的NaOH溶液.整个实验进程中溶液的pH变化曲线如图所示,下列叙述正确的是( )
常温下,将Cl2缓慢通入水中至饱和,然后向所得饱和氯水中滴加0.1mol•L-1的NaOH溶液.整个实验进程中溶液的pH变化曲线如图所示,下列叙述正确的是( )
 常温下,将Cl2缓慢通入水中至饱和,然后向所得饱和氯水中滴加0.1mol•L-1的NaOH溶液.整个实验进程中溶液的pH变化曲线如图所示,下列叙述正确的是( )
常温下,将Cl2缓慢通入水中至饱和,然后向所得饱和氯水中滴加0.1mol•L-1的NaOH溶液.整个实验进程中溶液的pH变化曲线如图所示,下列叙述正确的是( )| A. | 实验进程中可用pH试纸测定溶液的pH | |
| B. | 向a点所示溶液中通入SO2,溶液的酸性和漂白性均增强 | |
| C. | c点所示溶液中:c(Na+)=2c(ClO-)+c(HClO) | |
| D. | 由a点到b点的过程中,溶液中$\frac{c({H}^{+})}{c(CI{O}^{-})}$减小 |
12.生活中处处有化学,应用物质性质对下列物质用途的解释不正确的是( )
| A | B | C | D | |
| 用途 | 热的纯碱溶液可去油污 | 明矾可用于净水 | 抗坏血酸(Vc)可作抗氧化剂 | 液氨可做制冷剂 |
| 解释 | 纯碱水解呈碱性 | 明矾在水中生成的氢氧化铝胶体有吸附性 | Vc具有酸性 | 液氨汽化时吸收大量的热 |
| A. | A | B. | B | C. | C | D. | D |
19.日常生活中遇到的很多问题都涉及到化学知识,下列有关叙述正确的是( )
| A. | 在涂料中尽量用液态有机物代替水作溶剂,以减少环境污染 | |
| B. | 我国自行研制的“神七”航天服是由新型“连续纤维增韧”材料做成的,其主要成分是由碳化硅、陶瓷和碳纤维复合而成的,它是一种新型无机非金属材料 | |
| C. | 开发利用可燃冰(固态甲烷水合物),有助于海洋生态环境的治理 | |
| D. | 食物溶于水后的溶液 pH<7,则该食物为成酸性食物 |
16.如图中a、b、c、d为周期表前4周期的部分元素,下列叙述正确的是( )
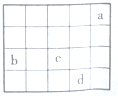

| A. | 四种元素中,d单质的化学性质最稳定 | |
| B. | 气态氢化物的还原性:d>c | |
| C. | 原子半径:b<c | |
| D. | b元素最高价氧化物可形成原子晶体 |
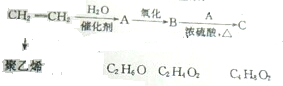
 ,该反应的单体为CH2=CH2,链节为-CH2-CH2-,聚合度为n.
,该反应的单体为CH2=CH2,链节为-CH2-CH2-,聚合度为n.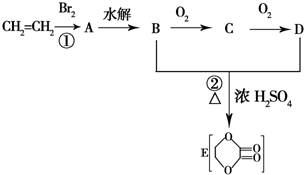 由乙烯和其他无机原料合成环状 化合物其合成过程如图(水及其他无机产物均已省略):
由乙烯和其他无机原料合成环状 化合物其合成过程如图(水及其他无机产物均已省略):