题目内容
18.工业制硫酸铜的方法很多.①方法一、用浓硫酸和铜制取硫酸铜.该反应的化学方程式是Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O,此法的最大缺点是产生有污染的气体.
②方法二、用稀硫酸、铜和氧化铁制取硫酸铜,生产的主要过程如图所示:
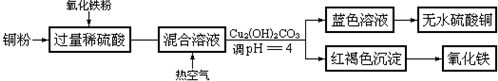
稀硫酸、铜和氧化铁反应的化学方程式是Fe2O3+3H2SO4═Fe2(SO4)3+3H2O、Fe2(SO4)3+Cu═2FeSO4+CuSO4
(或Fe2O3+Cu+3H2SO4═3H2O+2FeSO4+CuSO4);向混合溶液中通入热空气的反应的离子方程式是4Fe2++4H++O2═4Fe3++2H2O;由滤液得到无水硫酸铜的实验操作是加热蒸发.
分析 ①铜和浓硫酸加热反应生成硫酸铜、二氧化硫和水,反应生成的二氧化硫是污染环境的气体;
②依据流程图分析判断,稀硫酸、铜和氧化铁反应是氧化铁和稀硫酸反应生成硫酸铁和水,硫酸铁和铜反应生成氯化亚铁和氯化铜;通入热的空气是为了氧化亚铁离子为三价铁离子,调整溶液PH除去铁离子;溶液中得到溶质固体的方法是蒸发水结晶析出.
解答 解:①铜和浓硫酸加热反应生成硫酸铜、二氧化硫和水,反应的化学方程式为:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O;反应生成的二氧化硫是污染环境的气体,产生了有污染的气体;
故答案为:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O;产生了有污染的气体;
②依据流程转化图分析,铜需要硫酸和氧化铁反应生成的铁离子溶解生成铜离子,再通入空气氧化亚铁离子为铁离子,调节溶液PH使铁离子沉淀除去,得到硫酸铜溶液;加热蒸发浓缩结晶得到硫酸铜晶体;反应的化学方程式为:Fe2O3+3H2SO4═Fe2(SO4)3+3H2O、Fe2(SO4)3+Cu═2FeSO4+CuSO4(或Fe2O3+Cu+3H2SO4═3H2O+2FeSO4+CuSO4);通入空气的作用是氧气氧化亚铁离子为铁离子的反应,反应离子方程式为:4Fe2++4H++O2═4Fe3++2H2O;得到硫酸铜溶液加热蒸发得到硫酸铜晶体,
故答案为:Fe2O3+6H+═2Fe3++3H2O、2Fe3++Cu═2Fe2++Cu2+;4Fe2++4H++O2═4Fe3++2H2O;加热、蒸发.
点评 本题考查了浓硫酸、铁的化合物、铜的性质的应用,离子方程式的书写方法,除杂的方法,试剂选择原则,题目难度中等,注意工业制硫酸铜的方法的掌握.

 实验室用乙酸和正丁醇制备乙酸正丁酯.CH3COOH+CH3CH3CH2CH2OH$?_{△}^{浓硫酸}$CH3COOCH2CH2CH2CH3+H2O有关物质的相关数据如下表.
实验室用乙酸和正丁醇制备乙酸正丁酯.CH3COOH+CH3CH3CH2CH2OH$?_{△}^{浓硫酸}$CH3COOCH2CH2CH2CH3+H2O有关物质的相关数据如下表.| 化合物 | 相对分子质量 | 密度g.cm-3 | 沸点/ | 溶解度/100g水 |
| 正丁醇 | 74 | 0.80 | 118.0 | 9 |
| 冰醋酸 | 60 | 1.045 | 118.1 | 互溶 |
| 乙酸正丁酯 | 116 | 0.882 | 126.1 | 0.7 |
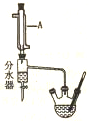
(1)仪器A的名称冷凝管.
(2)反应时加热有利于提高的产率,但温度过高酯的产率反而降低,其可能的原因是温度过高时,正丁醇、乙酸易挥发,且副反应增加,导致酯产率降低.
(3)用分水器分出冷凝水的目的使用分水器分离出水,使平衡正向移动,提高反应产率,步骤I中判断反应终点的依据是分水器中的水层量不再增加.
II.乙酸正丁酯粗产品的精制:
(1)将三颈圆底烧瓶中的液体转入分液漏斗中,并用饱和Na2CO3溶液洗涤有机层,该步骤作的目的是饱和Na2CO3溶液可溶解正丁醇,中和酸,从而除去产品中的杂质
(2)用分液法可分离上述有机层和水层,分液完成后,取出有机层的操作是有机层从分液漏斗上口倒入一个干燥的蒸馏烧瓶中.
(3)将酯层进行蒸馏.蒸馏手机乙酸正丁酯产品时,应将温度控制在126.1℃左右.
III.计算产率:称量制得的乙酸正丁酯的质量为12.76g,则乙酸正丁酯的产率为55%.
| A. | 质量数相同的不同原子,其化学性质一定相同 | |
| B. | 质子数相同的原子,其核外电子排布也相同 | |
| C. | 金属性越强,其原子在反应中越易失去电子 | |
| D. | 非金属性越强,其阴离子越难失去电子 |
| A. | 苯与硝酸在加热时发生取代反应,甲苯与硝酸在常温下就能发生取代反应 | |
| B. | 乙醇、苯酚都有羟基,但是电离常数不同 | |
| C. | 苯酚无需催化剂即能与溴水发生取代反应 | |
| D. | 1 mol甲苯能与3 mol H2发生加成反应 |
 甲烷分子中的4个氢原子都可以被取代,若甲烷分子中的4个氢原子都被苯基取代,可以得到的分子如图,对该分子的描述,不正确的是( )
甲烷分子中的4个氢原子都可以被取代,若甲烷分子中的4个氢原子都被苯基取代,可以得到的分子如图,对该分子的描述,不正确的是( )| A. | 分子式为C25H20 | B. | 所有的碳原子可能都在同一平面上 | ||
| C. | 所有原子一定在同一平面上 | D. | 此物质属于芳香烃类物质 |
| A. | Li | B. | Na | C. | F | D. | S |
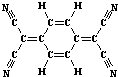
| A. | 分子中所有的氮原子在同一平面内 | B. | 属于芳香烃 | ||
| C. | 分子式为C12H4N4 | D. | 该物质难溶于水 |

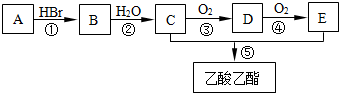
 CH3COOCH2CH3+H2O.
CH3COOCH2CH3+H2O.