题目内容
2.运用元素周期律分析下面的推断,其中错误的是( )| A. | 铍(Be)的氧化物的水化物可能具有两性 | |
| B. | 砹(At2)为有色固体;HAt不稳定;AgAt不溶于水也不溶于稀酸 | |
| C. | 硫酸锶(SrSO4)是难溶于水的白色固体 | |
| D. | 硒化氢(H2Se)是比H2S稳定的气体 |
分析 A、元素周期表中的对角线规则:处于对角线的元素具有相似性;
B、同主族元素性质具有相似性;
C、同主族元素性质具有相似性;
D、同主族元素的原子,从上到下氢化物的稳定性逐渐减弱.
解答 解:A、元素周期表中Be和Al处于对角线位置上,处于对角线的元素具有相似性,Be、BeO、Be(OH)2均有两性,故A正确;
B、卤族元素性质具有相似性,可推知砹(At)为有色固体;HAt不稳定;AgAt感光性很强,且不溶于水也不溶于稀酸,故B正确;
C、MgSO4、CaSO4、SrSO4溶解度依次减小,可以推知硫酸锶(SrSO4)是难溶于水的白色固体,故C正确;
D、同主族元素的原子,从上到下氢化物的稳定性逐渐减弱,所以硒化氢(H2Se)不如H2S稳定,故D错误.
故选D.
点评 本题考查同主族元素性质具有相似性也具有一定的递变规律,可以根据所学知识进行回答,难度不大.

练习册系列答案
相关题目
12.X、Y、Z均为短周期元素,X、Y处于同一周期,X、Z的最低价离子分别为X2-和Z-,Y+和Z-具有相同的电子层结构.下列说法正确的是( )
| A. | 原子最外层电子数:X>Y>Z | B. | 单质氧化性:X>Z>Y | ||
| C. | 离子半径:X2->Y+>Z- | D. | 原子序数:X>Y>Z |
10. 甲烷分子中的4个氢原子都可以被取代,若甲烷分子中的4个氢原子都被苯基取代,可以得到的分子如图,对该分子的描述,不正确的是( )
甲烷分子中的4个氢原子都可以被取代,若甲烷分子中的4个氢原子都被苯基取代,可以得到的分子如图,对该分子的描述,不正确的是( )
 甲烷分子中的4个氢原子都可以被取代,若甲烷分子中的4个氢原子都被苯基取代,可以得到的分子如图,对该分子的描述,不正确的是( )
甲烷分子中的4个氢原子都可以被取代,若甲烷分子中的4个氢原子都被苯基取代,可以得到的分子如图,对该分子的描述,不正确的是( )| A. | 分子式为C25H20 | B. | 所有的碳原子可能都在同一平面上 | ||
| C. | 所有原子一定在同一平面上 | D. | 此物质属于芳香烃类物质 |
17.对于NaHCO3与Na2CO3的性质,下列叙述错误的是( )
| A. | 质量相同时,跟足量的盐酸反应,在相同条件下Na2CO3产生的CO2气体多 | |
| B. | 物质的量相同时,跟足量的盐酸反应,Na2CO3所消耗H+的物质的量是NaHCO3的2倍 | |
| C. | 物质的量相同时,跟足量的盐酸反应,在相同条件下得到等体积的CO2 | |
| D. | 将它们分别加入到澄清石灰水中,都产生白色沉淀 |
7.下列元素中,原子半径最大的是( )
| A. | Li | B. | Na | C. | F | D. | S |
14.AlCl3易溶于四氯化碳,加热到180℃升华.推测三氯化铝有可能属于( )
| A. | 原子晶体 | B. | 分子晶体 | C. | 离子晶体 | D. | 金属晶体 |
11.下列各组物质中,属于同分异构体的是( )
| A. | O2和O3 | B. | H2O和H2O2 | ||
| C. | CH4和CH3CH3 | D. | 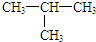 和CH3-CH2-CH2-CH3 和CH3-CH2-CH2-CH3 |
12.从结构上分析推测,CH2=CHCOOCH2CH3,最不可能具有的性质是( )
| A. | 能使溴水褪色 | B. | 能使酸性高锰酸钾溶液褪色 | ||
| C. | 能水解 | D. | 能够与Na2CO3溶液反应 |
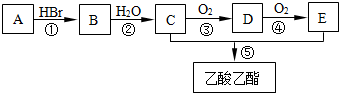
 CH3COOCH2CH3+H2O.
CH3COOCH2CH3+H2O.