题目内容
【题目】2019年是门捷列夫发现元素周期律150周年。某学习小组同学为探究同周期或同主族元素性质的递变规律,分别设计了如下实验:
Ⅰ.将少量等质量的钾、钠、镁、铝分别投入到足量的同浓度的盐酸中,试预测实验结果:
【1】上述金属中与盐酸反应最剧烈_____。
A.钾B.钠C.镁D.铝
【2】上述金属中与盐酸反应生成相同条件下的气体最多_____。
A.钾B.钠C.镁D.铝
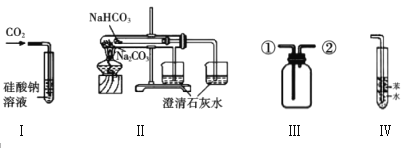
Ⅱ.利用图装置来验证同主族元素非金属性的变化规律:
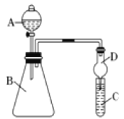
现要证明非金属性:Cl>I。在A中加浓盐酸,C中加淀粉碘化钾混合溶液,B中加某试剂。
常温下,通过合理操作,观察到C中溶液变蓝的现象,即可证明。
请结合装置回答下列问题:
【3】B中可加入_____
A.MnO2固体B.KMnO4固体C.浓H2SO4D.大理石
【4】仪器A的名称是_____
A.普通漏斗B.长颈漏斗C.分液漏斗D.容量瓶
【5】从环境保护的角度考虑,此装置尚缺少尾气处理装置,可用 吸收尾气。
A.澄清石灰水B.KBr溶液C.浓H2SO4D.NaOH溶液
【答案】
【1】A
【2】D
【3】B
【4】C
【5】D
【解析】
Ⅰ.(1)根据金属活动性顺序表可以判断钾、钠、镁、铝的活泼性,金属活泼性越强,与盐酸反应越剧烈;
(2)根据电子守恒比较生成氢气在相同条件下的体积大小;
Ⅱ.要证明非金属性:Cl>I,可根据氯气能够将碘离子氧化成碘单质,则B装置为氯气的制备装置;氯气有毒,多余的氯气用氢氧化钠溶液吸收,据此分析解答。
【1】金属活泼性顺序为:钾>钠>镁>铝,所以相同条件下与盐酸反应最激烈的是钾,反应速率最慢的是铝;故合理选项是A;
【2】生成1 mol氢气需要得到2 mol电子,钾、钠都是+1价的金属,1mol 钾质量是39g,失去1 mol电子,1 mol钠质量是23 g,失去1 mol电子,Mg是+2价的金属,1 mol镁质量是24g,失去2 mol电子,Al是+3价的金属,而1 mol铝质量是27 g,失去3 mol电子,所以等质量的四种金属失去电子的物质的量最多的是Al,则生成相同条件下氢气最多的是金属铝,故合理选项是D;
【3】根据以上分析,发生装置为氯气的制备装置,浓盐酸和高锰酸钾在常温下反应生成氯气,则B中可加入KMnO4固体,故合理选项是B;
【4】根据仪器的结构可知仪器A的名称是分液漏斗,故合理选项是C;
【5】氯气是有毒气体,在排放前要进行尾气处理,可根据氯气能够与碱反应的性质,多余的氯气用氢氧化钠溶液进行吸收,所以从环境保护的角度考虑,此装置尚缺少尾气处理装置,可用NaOH溶液吸收尾气,故合理选项是D。
本题考查了探究金属单质的金属性强弱、非金属单质的非金属性强弱比较方法,掌握判断金属性、非金属性强弱的方法是解题的关键。

 习题精选系列答案
习题精选系列答案