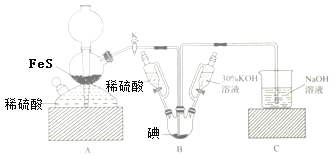
题目内容
【题目】用下列装置进行相应实验,能达到实验目的的是( )
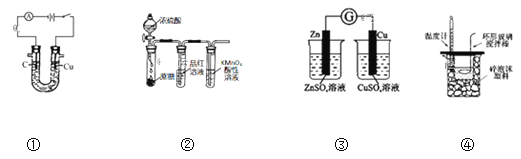
A.图①所示装置可电解食盐水制氯气和氢气
B.图②所示装置可说明浓H2SO4具有脱水性、强氧化性,SO2具有漂白性、还原性
C.图③装置可以用来验证化学能转化为电能
D.图④测定中和热
【答案】B
【解析】
A. 阳极是铜失电子变为Cu2+进入溶液,图①所示装置不可电解食盐水制氯气和氢气,故A错误;
B. 浓硫酸使蔗糖脱水后,C与浓硫酸反应生成二氧化硫,二氧化硫使品红褪色,二氧化硫被高锰酸钾氧化,则可说明浓H2SO4具有脱水性、强氧化性,SO2具有漂白性、还原性,故B正确;
C. 图③装置不能形成闭合回路,无法用来验证化学能转化为电能,故C错误;
D. 图④中温度计无法测量反应混合液的温度,中和热测定实验中,温度计应插在小烧杯中的混合溶液中,故D错误;
故选B。

练习册系列答案
 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案
相关题目