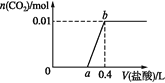
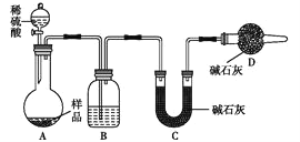
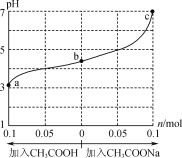
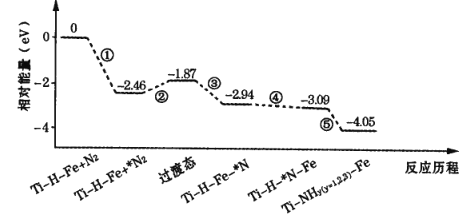
题目内容
【题目】把过量铁屑加入FeCl3、CuCl2的混合溶液中,反应结束后,称得剩余固体的质量与所加铁屑的质量相等。则原溶液中FeCl3与CuCl2的物质的量之比是( )
A.7∶2B.3∶2
C.2∶3D.2∶7
【答案】D
【解析】
根据反应①2Fe3++Fe=3Fe2+可知,铁溶解,固体质量减少,根据反应②Cu2++Fe=Cu+Fe2+可知,铁溶解,铜析出,固体质量增加,而反应结束后,称得剩余固体质量与所加铁屑的质量相等,则反应①中固体减少的质量与反应②中固体增加的质量相等,即56 g·mol-1×![]() =(64g·mol-1-56g·mol-1)×n(Cu2+),得n(Fe3+)∶n(Cu2+)=2∶7,故n(FeCl3)∶n(CuCl2)=2∶7,故答案为D。
=(64g·mol-1-56g·mol-1)×n(Cu2+),得n(Fe3+)∶n(Cu2+)=2∶7,故n(FeCl3)∶n(CuCl2)=2∶7,故答案为D。
【点睛】
考查Fe3+、Cu2+的氧化能力大小的比较,能正确判断固体的成分是解本题的关键;根据Fe3+、Cu2+的氧化性强弱判断反应先后顺序,从而确定固体的成分、溶液的成分;有固体剩余,若固体只有铜,则反应后的溶液中一定无Fe3+存在,一定存在Fe2+,可能含有Cu2+;若有铁剩余,一定有铜生成,Fe3+和Cu2+无剩余。
【题型】单选题
【结束】
7
【题目】下列说法正确的是( )
A.绿矾是含有一定量结晶水的硫酸亚铁,在试管中加入少量绿矾样品,加水溶解,滴加KSCN溶液,溶液颜色无明显变化。再向试管中通入空气,溶液逐渐变红。由此可知:样品中没有Fe3+,Fe2+易被空气氧化为Fe3+
B.在给定条件下,Fe![]() FeCl2
FeCl2![]() Fe(OH)2可以实现
Fe(OH)2可以实现
C.Fe与Cl2反应生成FeCl3,推测Fe与I2反应生成FeI3
D.铁比铜金属性强,故用FeCl3溶液腐蚀印刷电路板上的铜
【答案】A
【解析】
A.滴加KSCN溶液,溶液颜色无明显变化,可知样品中没有Fe3+,但Fe2+不稳定,易被空气中氧气氧化生成Fe3+,最终溶液变红色,故A正确;
B.氯气具有强氧化性,因此铁与氯气反应生成三氯化铁,而不是氯化亚铁,故B错误;
C.因I2的氧化性较弱,故与铁反应生成FeI2,故C错误;
D.2FeCl3+Cu=2FeCl2+CuCl2不是置换反应,该反应与铁、铜的金属性强弱无关,故D错误;
故答案为A。

【题目】根据下列实验操作和现象所得出的结论正确的是
选项 | 实验操作和现象 | 结论 |
A | 向BaCl2溶液中通入SO2和气体X,出现白色沉淀 | 气体X一定作氧化剂 |
B | NaHCO3溶液与NaAlO2溶液混合,立即产生白色沉淀 | 结合H+的能力:AlO2->CO32- |
C | 向盛有Cu2O的试管中加入足量稀硫酸,溶液变为蓝色,试管底有红色沉淀 | 氧化性:H+>Cu2+ |
D | 向2支盛有2mL0.1mol/LNaOH溶液的试管中分别滴入2滴0.1mol/LAlCl3、MgCl2溶液,振荡,前者无沉淀,后者有白色沉淀 | Ksp[Al(OH)3]>Ksp[Mg(OH)2] |
A.AB.BC.CD.D