题目内容
【题目】化学小组设计以下实验方案,测定某部分变质为碳酸钠的小苏打样品中NaHCO3的质量分数。
(1)方案一:称取一定质量样品,置于仪器a中用酒精灯加热至恒重,冷却,用托盘天平称量剩余固体质量。重复操作,计算。仪器a的名称是____________。
(2)方案二:称取此混合物9.5g,溶于水中,配成100 mL溶液。利用化学反应把HCO3—、CO32—完全转化为沉淀,称量干燥沉淀的质量,由此计算混合物中ω(NaHCO3)。
①取配制好的溶液于烧杯中,滴加足量沉淀剂,把溶液中HCO3—、CO32—完全转化为沉淀,应选用的试剂
是____________ (填字母)。
A CaCl2溶液 B MgSO4溶液 C NaCl溶液 D Ba(OH)2溶液
②过滤,提取沉淀,则过滤操作所需要的玻璃仪器除玻璃棒、烧杯外,还有____________。
③将沉淀洗涤,并充分干燥,称量沉淀的质量为19.7g。由此可以计算ω(NaHCO3)= ____________。
(3)方案三:称取一定质量样品,按如图装置进行实验:
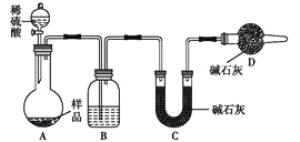
①B装置内所盛试剂是____________;
②D装置的作用是________。
③某同学认为上述测定结果__________(填“偏高”或“偏低”),因为实验装置还存在一个明显的缺陷是________________。
【答案】坩埚 D 漏斗 44.2%或0.442合理即可 浓硫酸 防止空气中的水蒸气、CO2进入C装置 偏低 缺少一套将A、B装置内的CO2气体驱赶到C装置中的装置(或其他合理答案
【解析】
(1)基本仪器的识别;
(2)混合物含量的测定、过滤操作等;
(3)实验方案的设计与评价以及误差分析等。
(1)用于灼烧的仪器为坩埚;
(2)①欲使碳酸根和碳酸氢根均完全沉淀,所以应加入含有氢氧根的溶液,结合给定的物质可知只能选用氢氧化钡溶液,即D;
②过滤时需要的玻璃仪器有烧杯、玻璃棒和漏斗;
③设碳酸钠和碳酸氢钠的物质的量分别为a、b,则可得106a+84b=9.5,197(a+b)=19.7,联立解得a=b=0.05mol,所以碳酸氢钠的质量分数为 ×100%=44.2%;
×100%=44.2%;
(3)①根据实验目的可知B装置的作用是除去二氧化碳中的水蒸气,故选用浓硫酸;
②由于该方案是通过测定二氧化碳的质量进而确定物质的质量分数,因此为减小实验误差,D装置的作用是防止空气中的水蒸气、CO2进入C装置;
③由于系统内残留有二氧化碳,因此C装置测定的二氧化碳的质量偏低,从而导致碳酸氢钠的含量测定结果偏低;存在的明显缺陷为缺少一套将A、B装置内的CO2气体驱赶到C装置中的装置。

 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案




