题目内容
【题目】工业上用铝土矿(主要成分是Al2O3,还有少量的Fe2O3、SiO2)提取冶炼铝的原料氧化铝,工艺流程如图:
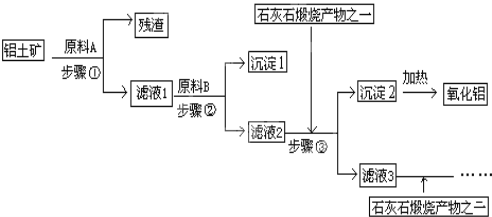
(1)原料A的名称是______,步骤①反应的离子方程式是__________、 ________;
(2)滤液1中要加入稍过量原料B,原料B的化学式是______,步骤②反应的子方程式是:________________、 ____________、 _____________;
(3)步骤③主要的化学方程式是:_________;
(4)滤液3中的离子主要有______, 该流程中哪些物质可循环使用_________。
【答案】盐酸 Al2O3+6H+=2Al3++3H2O、 Fe2O3+6H+=2Fe3++3H2O NaOH H++OH-=H2O Fe3++3OH-=Fe(OH)3↓ Al3++4OH-=AlO2-+2H2O NaAlO2+CO2+2H2O=Al(OH)3↓+NaHCO3 Na+、OH-、Cl-、HCO3- NaOH、CaCO3
【解析】
由工艺流程可知步骤③通入的为二氧化碳,生成的沉淀为氢氧化铝,所以滤液2含有AlO2-,步骤②应加入过量氢氧化钠,所以滤液1中含有Al3+,步骤①应为加入盐酸,除去SiO2。
(1)由上述分析可知,步骤①加入盐酸,除去SiO2,所以原料A为盐酸,氧化铝与酸反应离子方程式为Al2O3+6H+=2Al3++3H2O,氧化铁与盐酸反应离子方程式为Fe2O3+6H+=2Fe3++3H2O,残渣的成分是和盐酸不反应的SiO2;
(2)滤液①中含有过量的盐酸,以及生成的氯化铝和氯化铁,所以加入过量的氢氧化钠可以除去氯化铁,所以原料B是NaOH,加入过量的氢氧化钠反应的离子方程式是H++OH-=H2O、Fe3++3OH-=Fe(OH)3 ↓、Al3++4OH-=AlO2-+2H2O。
(3)滤液②中含有过量的氢氧化钠以及生成的偏铝酸钠,所以通入过量的CO2时的化学方程式是NaOH+CO2=NaHCO3、NaAlO2+CO2+2H2O=Al(OH)3↓+NaHCO3,主要反应是NaAlO2+CO2+2H2O=Al(OH)3↓+NaHCO3;
(4) 滤液②中含有过量的氢氧化钠以及生成的偏铝酸钠、氯化钠,所以通入过量的CO2生成碳酸氢钠和氢氧化铝沉淀,滤液3中溶质主要是碳酸氢钠、氯化钠,离子主要有Na+、OH-、Cl-、HCO3-, 向其中加入过量的氧化钙,氧化钙与水反应生成的氢氧化钙与碳酸氢钠反应生成氢氧化钠和碳酸钙沉淀,所以该流程中可循环使用的是NaOH、CaCO3。

【题目】在温度、容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下[已知N2(g)+3H2(g)![]() 2NH3(g) ΔH=-92.4 kJ·mol-1],下列说法正确的是( )
2NH3(g) ΔH=-92.4 kJ·mol-1],下列说法正确的是( )
容器 | 甲 | 乙 | 丙 |
反应物投入量 | 1 mol N2、 3 mol H2 | 2 mol NH3 | 4 mol NH3 |
NH3的浓 度/mol·L-1 | c1 | c2 | c3 |
反应的能量变化 | 放出a kJ | 吸收b kJ | 吸收c kJ |
体系压强(Pa) | p1 | p2 | p3 |
反应物转化率 | α1 | α2 | α3 |
A. 2c1>c3B. α1+α3<1C. 2p2<p3D. a+b>92.4
【题目】一定温度下,在3个1.0 L的恒容密闭容器中分别进行反应2X(g)+Y(g)![]() Z(g) ΔH,达到平衡。相关数据如下表。
Z(g) ΔH,达到平衡。相关数据如下表。
容器 | 温度/K | 物质的起始浓度/ mol·L-1 | 物质的平衡浓度/ mol·L-1 | ||
c(X) | c(Y) | c(Z) | c(Z) | ||
I | 400 | 0.20 | 0.10 | 0 | 0.080 |
II | 400 | 0.40 | 0.20 | 0 | a |
III | 500 | 0.20 | 0.10 | 0 | 0.025 |
下列说法不正确的是
A. 平衡时,X的转化率:II>I
B. 平衡常数:K(II)>K(I)
C. 达到平衡所需时间:III<I
D. 反应的ΔH<0