��Ŀ����
)2013��ȫ�������������������ص����������������ǵij��м���������˼����Σ��������о�NO2��SO2��CO�ȴ�����Ⱦ����Ĵ���������Ҫ���塣
I������������Ч����SO2�Կ�������Ⱦ��
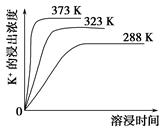
��1����ˮ�������ԣ���Ҫ����Na+��K+��Ca2+��Mg2+��CI-��SO42-��Br-��HCO3-�����ӡ���SO2�����������ú�ˮ�����乤����������ͼ��ʾ��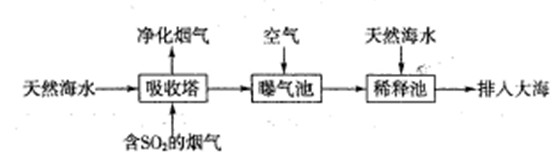
������������ͨ�������Ŀ����
��ͨ��������������к�ˮ����Ȼ��ˮ��ȣ�Ũ��û�����Ա仯�������� ��
a��Cl- B��SO42- C��HCO3-
��2����NaOH��Һ���������е�SO2�������õ�Na2SO3��Һ���е�⣬��ѭ������NaOH��ͬʱ�õ�H2SO4����ԭ������ͼ��ʾ��(�缫����Ϊʯī)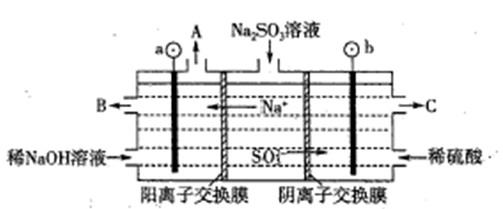
��ͼ��b��Ҫ���ӵ��(���������) ����C�������������� ��
��SO32-�ŵ�ĵ缫��ӦʽΪ
�۵�����������������������ǿ����ƽ���ƶ�ԭ������ԭ�� ��
II���ҹ��������ѽṹ��ȼúΪ������ú�����ɼ��ٻ�����Ⱦ����ú�����������ܲ����к�����H2S����������Na2CO3��Һ�����գ��÷�Ӧ�����ӷ���ʽΪ ��
(��֪��H2S Kal=9��1��10-8��Ka2=1��1 ��10-12��H2CO3 Kal=4��30��10-7��Ka2=5��61 ��10-11)
��1���ٽ�H2SO3��HSO3-������ΪSO42-; ��a ��2������ �����SO32- -2e-+H2O=SO42-+2H+;
��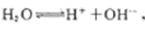 ������H+�ŵ�����H2��c��H+����С��ˮ�ĵ���ƽ�������ƶ���������ǿ��
������H+�ŵ�����H2��c��H+����С��ˮ�ĵ���ƽ�������ƶ���������ǿ��
�� CO32-+H2S=HCO3-+HS-.
���������������2���������������ӵ��ƶ�����a�����ӵ�Դ������b�����ӵ�Դ����������b������������Ӧ�����������C��������������H+�ŵ�����H2��c��H+����С��ˮ�ĵ���ƽ�������ƶ���������ǿ������������Na2CO3��Һ����H2S����H2S Kal=9��1��10-8��Ka2=1��1 ��10-12��H2CO3 Kal=4��30��10-7��Ka2=5��61 ��10-11����֪����ǿ��˳��ΪH2CO3> H2S >HCO3->HS-,�Ӷ���Ӧ�����ӷ���ʽΪCO32-+H2S=HCO3-+HS-.
���㣺Ԫ�ػ�����֪ʶ�����ԭ����ԭ���ԭ����

 ��ѧ�̸̳����¿α�ϵ�д�
��ѧ�̸̳����¿α�ϵ�д� Сѧ��ʱ��ѵϵ�д�
Сѧ��ʱ��ѵϵ�д���ҵ�Ͻ���ȡ�ظ����(K2Cr2O7)������(CrO3)��ʣ�������Ϊ��������ɷ�ΪSiO2��Al2O3��MgO��Fe2O3��CrO3��K2Cr2O7�ȡ�
��֪��
���ظ���غ�������������ˮ��������ɸ���Ⱦ����Ҫԭ�����Ƕ���ǿ������������������ˮ�����ԣ�
�ڣ�6�۸��ױ��������գ����°�����3�۸����ױ��������գ�����С��
���±�ΪһЩ�����������������pH�������ݡ�
| ���� | ��ʼ���� | ��ȫ���� |
| Fe(OH)3 | 2.7 | 3.7 |
| Al(OH)3 | 3.7 | 4.7 |
| Cr(OH)3 | 4.7 | a |
| Fe(OH)2 | 7.6 | 9.6 |
| Mg(OH)2 | 9.6 | 11.1 |
�ش����д�����������������Ⱦ���й����⣺
(1)��������ϡ�����ȡ�����ˣ��ڽ���Һ�м����������̷�(FeSO4��7H2O)�������̷���Ŀ����_____________________________________________
(2)�������Һ�л��������ռ��pH�պôﵽ4.7�����ˣ����ó����Ļ�ѧʽ��____________________________________________________________��
�����£�Cr(OH)3���ܶȻ�Ksp��10��32��ҪʹCr3����ȫ����[c(Cr3��)����10��5 mol��L��1��Ϊ������ȫ]����Һ��pHӦ����a��________��
(3)��(2)�еõ�����Һ�м������ᣬ��������ǿ���ԣ����õ���Һ�Ǻ�____________________���ʵ���Һ��
��֪0.1mol/L H2SO4��ˮ�еĵ�һ����������ȫ�ģ��ڶ������벢����ȫ����������0.1mol/L�����¼�����Һ�ĵ���ȣ����Ѿ�����ķ�����ռԭ�����������İٷ��������±����ش��������⣺
| ��H2SO4��Һ�е�HSO4�C | ��NaHSO4��Һ�е�HSO4�C | ��CH3COOH | ��HCl��Һ |
| 10�� | 29�� | 1.33�� | 100�� |
��2�������£����������µĢ���Һ��c(H+)������������ ����
��3�������£�pH��ͬ������������Һ�������ʵ���Ũ���ɴ�С��˳���ǣ�����ţ��� ��
��4������10mL���������µ�NaHSO4��Һ��0.1mol/LNaOH��Һ�������ϣ����Ϻ���Һ������Ũ���ɴ�С˳��Ϊ ��
��5������������������CH3COOH�ĵ��볣��Ka�� ���������£���b mol��L�C1��CH3COONaҺ��0.01 mol��L�C1������������ϣ���Ӧ��ƽ��ʱ�������Һ��pH��7���ú�b�Ĵ���ʽ��ʾCH3COOH�ĵ��볣��Ka�� ��
�������������Ű�ҹ��ֵ���������SO2����ɿ�������Ⱦ����Ҫԭ�������Ƽ�ѭ�����ɳ�ȥSO2��
��1���Ƽ�ѭ�����У�����ҺΪNa2SO3��Һ���÷�Ӧ�����ӷ���ʽ��________��
��2����֪H2SO3�ĵ��볣��ΪK1��1.54��10��2��K2��1.024��10��7��H2CO3�ĵ��볣��ΪK1��4.30��10��7��K2��5.60��10��11�������������Դ����������______������ţ���
A.CO32�� HSO3�� B. HCO3�� HSO3�� C. SO32�� HCO3�� D. H2SO3 HCO3��
��3������Һ����SO2�Ĺ����У�pH��n(SO32��):n(HSO3��)�仯��ϵ���±���
| n(SO32��):n(HSO3��) | 91:9 | 1:1 | 1:91 |
| pH | 8.2 | 7.2 | 6.2 |
�ٸ����ϱ��ж�NaHSO3��Һ��_______�ԣ��Խ���ԭ��__________________________��
����NaHSO3��Һ������Ũ�ȹ�ϵ����ȷ����_______������ţ���
A��c(Na+)��2c(SO32-)+c(HSO3-)
B��c(Na+)��c(HSO3-)��c(H+)��c(SO32-)��c(OH-)
C��c(H2SO3)+ c(H+)��c(SO32-)+c(OH-)
D��c(Na+)+ c(H+)��2c(SO32-)+ c(HSO3-)+ c(OH-)
��4��������Һ��pH����ԼΪ6ʱ�����������۴�����ֱ���õ�pH��8������Һ��ѭ�����ã����ʾ��ͼ���£�
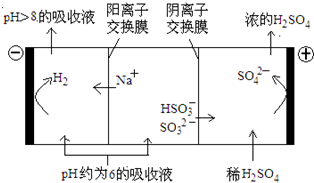
��д�������Ϸ����ĵ缫��Ӧʽ____________��
�ڵ��缫����1mol����ת��ʱ�������������Ϊ__________��

 ����ʹ����ѪҺpH������7.35~7.45�����á������õ������Һ�е�ƽ�����:������������������������������(�����ӷ���ʽ��ʾ)��
����ʹ����ѪҺpH������7.35~7.45�����á������õ������Һ�е�ƽ�����:������������������������������(�����ӷ���ʽ��ʾ)�� 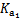 ������������
������������  ��������������10%��������Ƽ�ʵ��֤����ͬѧ�Ĺ۵��Ƿ���ȷ
��������������10%��������Ƽ�ʵ��֤����ͬѧ�Ĺ۵��Ƿ���ȷ  2Ca2����2K����Mg2����4SO42����2H2O
2Ca2����2K����Mg2����4SO42����2H2O
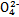 ��S
��S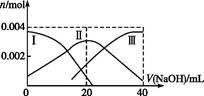
 H++OH-��KW=10-14
H++OH-��KW=10-14 b(����ڡ���С�ڡ����ڡ�)����a��b��ʾNH3��H2O�ĵ���ƽ�ⳣ��Ϊ����������
b(����ڡ���С�ڡ����ڡ�)����a��b��ʾNH3��H2O�ĵ���ƽ�ⳣ��Ϊ����������  ��
��  �� c��H+����c��OH-���ij˻� �� OH�������ʵ���
�� c��H+����c��OH-���ij˻� �� OH�������ʵ���