题目内容
【题目】2017年5月18日中共中央国务院公开致电祝贺南海北部神狐海域进行的“可燃冰”试采成功。“可燃冰”是天然气水合物,外形像冰,在常温常压下迅速分解释放出甲烷,被称为未来新能源。
(1)“可燃冰”作为能源的优点是__________(回答一条即可)。
(2)甲烷自热重整是先进的制氢方法,包含甲烷氧化和蒸汽重整两个过程。向反应系统同时通入甲烷,氧气和水蒸气,发生的主要化学反应如下:
反应过程 | 化学方程式 | 焓变△H(kJ.mol-l) | 活化能E.(kJ.mol-1) |
甲烷氧化 | CH4(g)+O2(g) | -802.6 | 125.6 |
CH4(g)+O2(g) | -322.0 | 172.5 | |
蒸气重整 | CH4(g)+H2O(g) | +206.2 | 240.1 |
CH4(g)+2H2O(g) | +158.6 | 243.9 |
回答下列问题:
①在初始阶段,甲烷蒸汽重整的反应速率______(填“大于”“小于”或“等于”)甲烷氧化的反应速率。
②反应CH4(g)+H2O(g)![]() CO(g)+3H2(g)的平衡转化率与温度、压强关系[其中n(CH4):n(H2O)=1:1]如图所示。
CO(g)+3H2(g)的平衡转化率与温度、压强关系[其中n(CH4):n(H2O)=1:1]如图所示。
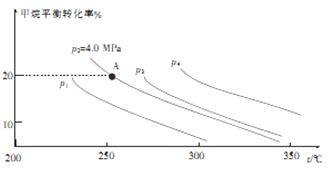
该反应在图中A点的平衡常数Kp=________(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数),图中压强(p1、p2、p3、p4)由大到小的顺序为___________。
③从能量角度分析,甲烷自热重整方法的先进之处在于___________。
④如果进料中氧气量过大,最终会导致H2物质量分数降底,原因是__________。
(3)甲烷超干重整CO2技术可得到富含CO的气体,其能源和开境上的双重意义重大,甲烷超干重整CO2的催化转化原理如图所示。
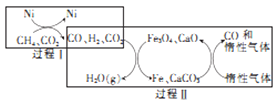
①过程II中第二步反应的化学方程式为_____________。
②只有过程I投料比![]() _______,过程II中催化剂组成才会保持不变。
_______,过程II中催化剂组成才会保持不变。
③该技术总反应的热化学方程式为______________。
【答案】 能量密度高、清洁、污染小、储量大 小于 ![]() (Mpa)2或0.1875(Mpa)2 p1>p2>p3>p4 甲烷氧化反应放出热量正好洪蒸汽重整反应所吸收自热量,达到能量平衡 氧气量过大,会将H2氧化导致H2物质量分数降低 3Fe+4CaCO3
(Mpa)2或0.1875(Mpa)2 p1>p2>p3>p4 甲烷氧化反应放出热量正好洪蒸汽重整反应所吸收自热量,达到能量平衡 氧气量过大,会将H2氧化导致H2物质量分数降低 3Fe+4CaCO3![]() Fe3O4+4CaO+4CO↑ 1/3 CH4(g)+ 3CO2(g)
Fe3O4+4CaO+4CO↑ 1/3 CH4(g)+ 3CO2(g)![]() 2H2O(g) +4CO(g) △H=+349kJ/mol
2H2O(g) +4CO(g) △H=+349kJ/mol
【解析】(1). “可燃冰”分子结构式为:CH4·H2O,是一种白色固体物质,外形像冰,有极强的燃烧力,可作为上等能源。它主要由水分子和烃类气体分子(主要是甲烷)组成,所以也称它为甲烷水合物,它的优点:能量密度高、清洁、污染小、储量大等;正确答案:能量密度高、清洁、污染小、储量大。
(2)①从表中活化能数据看出在初始阶段,甲烷蒸汽重整反应活化能较大,而甲烷氧化的反应活化能均较小,所以甲烷氧化的反应速率快;正确答案:小于。
② 根据题给信息,假设甲烷有1mol, 水蒸气有1mol,
CH4(g)+ H2O(g)![]() CO(g)+ 3H2(g)
CO(g)+ 3H2(g)
起始量 1 1 0 0
变化量 0.2 0.2 0.2 0.6
平衡量 0.8 0.8 0.2 0.6
平衡后混合气体的总量:0.8+0.8+0.2+0.6=2.4 mol;各物质分压分别为:p(CH4)=p(H2O)=4×0.8÷2.4=4/3,p(C0)= 4×0.2÷2.4=1/3, p(H2)=4×0.6÷2.4=1,A点的平衡常数Kp=13×1/3÷(4/3)2=3/16;根据图像分析,当温度不变时,压强减小,平衡左移,甲烷的转化率增大,所以压强的大小顺序:p1>p2>p3>p4;正确答案3/16;p1>p2>p3>p4。
③甲烷氧化反应放出热量正好提供给甲烷蒸汽重整反应所吸收热量,能量达到充分利用;正确答案:甲烷氧化反应放出热量正好洪蒸汽重整反应所吸收自热量,达到能量平衡。
④氧气量过大,剩余的氧气会将H2氧化为水蒸气,会导致H2物质量分数降低;正确答案:氧气量过大,会将H2氧化导致H2物质量分数降低。
(3)①根据图示分析,第一步反应是还原剂把四氧化三铁还原为铁,第二步反应是铁被碳酸钙氧化为四氧化三铁,而本身被还原为一氧化碳;正确答案:3Fe+4CaCO3![]() Fe3O4+4CaO+4CO↑。
Fe3O4+4CaO+4CO↑。
②反应的历程:①CH4(g)+ CO2(g)![]() 2H2(g) +2CO(g);②Fe3O4(s)+4H2
2H2(g) +2CO(g);②Fe3O4(s)+4H2![]() 3Fe(s)+4H2O(g); ③Fe3O4(s)+4 CO(g)
3Fe(s)+4H2O(g); ③Fe3O4(s)+4 CO(g)![]() 3Fe(s)+4 CO2(g);三个反应消去Fe3O4和Fe,最终得到CH4(g)+ 3CO2(g)
3Fe(s)+4 CO2(g);三个反应消去Fe3O4和Fe,最终得到CH4(g)+ 3CO2(g)![]() 2H2O(g) +4CO(g);所以只有过程I投料比
2H2O(g) +4CO(g);所以只有过程I投料比![]() 1/3时,才能保证II中催化剂组成保持不变;正确答案:1/3。
1/3时,才能保证II中催化剂组成保持不变;正确答案:1/3。
③ ①CH4(g)+3/2O2(g)![]() CO(g)+2H2O(g) △H1=-802.6 kJ.mol-l;
CO(g)+2H2O(g) △H1=-802.6 kJ.mol-l;
②CH4(g)+O2(g)![]() CO2(g)+2H2(g) △H2=-322.0 kJ.mol-l;
CO2(g)+2H2(g) △H2=-322.0 kJ.mol-l;
③CH4(g)+2H2O(g)![]() CO2(g)+4H2(g) △H3=+158.6 kJ.mol-l;
CO2(g)+4H2(g) △H3=+158.6 kJ.mol-l;
②×1.5-①得方程式⑤:1/2 CH4(g)+ CO(g)+ 2H2O(g)=3/2 CO2(g)+3 H2(g),△H4=3/2△H2-△H1; 然后再进行③×3-⑤![]() 2H2O(g) +4CO(g),△H=+349kJ/mol;正确答案:CH4(g)+ 3CO2(g)
2H2O(g) +4CO(g),△H=+349kJ/mol;正确答案:CH4(g)+ 3CO2(g)![]() 2H2O(g) +4CO(g),△H=+349kJ/mol。
2H2O(g) +4CO(g),△H=+349kJ/mol。

【题目】镧系为元素周期表中第ⅢB族、原子序数为57~71的元素。
(1)镝(Dy)的基态原子电子排布式为[Xe]4f106s2,画出镝(Dy)原子外围电子排布图:___________。
(2)高温超导材料镧钡铜氧化物中含有Cu3+,基态时Cu3+ 的电子排布式为________________。
(3)观察下面四种镧系元素的电离能数据,判断最有可能显示+3 价的元素是___________(填元素名称)。几种镧系元素的电离能(单位:kJ mol-1)
元素 | I1 | I2 | I3 | I4 |
Yb(镱) | 604 | 1217 | 4494 | 5014 |
Lu(镥) | 532 | 1390 | 4111 | 4987 |
La(镧) | 538 | 1067 | 1850 | 5419 |
Ce(铈) | 527 | 1047 | 1949 | 3547 |
(4)元素铈(Ce)可以形成配合物(NH4)2[Ce(NO3)6]。
①组成配合物的四种元素,电负性由大到小的顺序为________________(用元素符号表示)。
②写出氮的最简单气态氢化物水溶液中存在的氢键:__________________(任写一种)。
③元素Al 也有类似成键情况,气态氯化铝分子表示为(AlCl3)2,分子中Al 原子杂化方式为_____________,分子中所含化学键类型有______________(填字母)。
a.离子键 b.极性键 C.非极性键 d.配位键
(5)PrO2(二氧化镨)的晶体结构与CaF2相似,晶胞中镨原子位于面心和顶点,则PrO2(二氧化镨)的晶胞中有________个氧原子;已知晶胞参数为a pm,密度为ρ g· cm-3,NA=_____________ (用含a、ρ的代数式表示)。