题目内容
【题目】人工肾脏可采用间接电化学方法除去代谢产物中的尿素(CO(NH2)2),原理如图所示。

(1)电源的正极为________(填“A”或“B”)。
(2)阳极室中发生的反应依次为_________、_________。
(3)电解结束后,阴极室溶液的pH与电解前相比将__________;(填“增大”、“减小”或“不变”),若两极共收集到气体8.96 L(标准状况),则除去的尿素为________ g(忽略气体的溶解)。
【答案】 A 2Cl--2e-===Cl2↑ CO(NH2)2+3Cl2+H2O===N2+CO2+6HCl 不变 4.8
【解析】本题主要考查电解池原理。
(1)右边电极产生还原产物H2,所以电源的正极为A。
(2)阳极室中发生的反应依次为2Cl--2e-===Cl2↑ 、CO(NH2)2+3Cl2+H2O===N2+CO2+6HCl。
(3)阴极反应:2H2O+2e-![]() H2↑+2OH-,同时H+从左到右通过质子交换膜,因此,电解结束后,阴极室溶液的pH与电解前相比不变。3H2~CO(NH2)2~N2+CO2,每除去60g尿素,同时生成5mol气体,若两极共收集到气体8.96 L即0.4mol(标准状况),则除去的尿素4.8g。
H2↑+2OH-,同时H+从左到右通过质子交换膜,因此,电解结束后,阴极室溶液的pH与电解前相比不变。3H2~CO(NH2)2~N2+CO2,每除去60g尿素,同时生成5mol气体,若两极共收集到气体8.96 L即0.4mol(标准状况),则除去的尿素4.8g。

【题目】为实现下列实验目的,下表提供的主要仪器和所用试剂合理的是( )
选项 | 实验目的 | 主要仪器 | 所用试剂 |
A | 提纯混有MgCl2杂质的AlCl3溶液 | 烧杯、分液漏斗、胶头滴管、铁架台 | 待提纯的AlCl3溶液、NaOH溶液 |
B | 检验NH4Cl固体中的阳离子 | 试管、酒精灯 | NH4Cl固体、红色石蕊试纸、蒸馏水 |
C | 实验室制取CO2 | 试管、带导管的橡胶塞 | 大理石、稀硫酸 |
D | 测定FeSO4溶液的浓度 | 酸式滴定管、锥形瓶、 烧杯 | 0.100 mol·L-1 KMnO4标准溶液、FeSO4溶液 |
A. A B. B C. C D. D
【题目】2017年5月18日中共中央国务院公开致电祝贺南海北部神狐海域进行的“可燃冰”试采成功。“可燃冰”是天然气水合物,外形像冰,在常温常压下迅速分解释放出甲烷,被称为未来新能源。
(1)“可燃冰”作为能源的优点是__________(回答一条即可)。
(2)甲烷自热重整是先进的制氢方法,包含甲烷氧化和蒸汽重整两个过程。向反应系统同时通入甲烷,氧气和水蒸气,发生的主要化学反应如下:
反应过程 | 化学方程式 | 焓变△H(kJ.mol-l) | 活化能E.(kJ.mol-1) |
甲烷氧化 | CH4(g)+O2(g) | -802.6 | 125.6 |
CH4(g)+O2(g) | -322.0 | 172.5 | |
蒸气重整 | CH4(g)+H2O(g) | +206.2 | 240.1 |
CH4(g)+2H2O(g) | +158.6 | 243.9 |
回答下列问题:
①在初始阶段,甲烷蒸汽重整的反应速率______(填“大于”“小于”或“等于”)甲烷氧化的反应速率。
②反应CH4(g)+H2O(g)![]() CO(g)+3H2(g)的平衡转化率与温度、压强关系[其中n(CH4):n(H2O)=1:1]如图所示。
CO(g)+3H2(g)的平衡转化率与温度、压强关系[其中n(CH4):n(H2O)=1:1]如图所示。
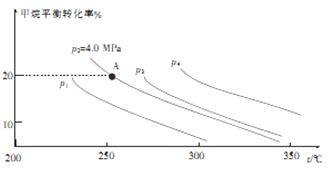
该反应在图中A点的平衡常数Kp=________(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数),图中压强(p1、p2、p3、p4)由大到小的顺序为___________。
③从能量角度分析,甲烷自热重整方法的先进之处在于___________。
④如果进料中氧气量过大,最终会导致H2物质量分数降底,原因是__________。
(3)甲烷超干重整CO2技术可得到富含CO的气体,其能源和开境上的双重意义重大,甲烷超干重整CO2的催化转化原理如图所示。
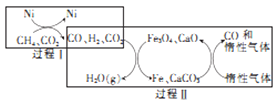
①过程II中第二步反应的化学方程式为_____________。
②只有过程I投料比![]() _______,过程II中催化剂组成才会保持不变。
_______,过程II中催化剂组成才会保持不变。
③该技术总反应的热化学方程式为______________。