题目内容
【题目】以铅蓄电池为电源,石墨为电极电解CuSO4溶液,装置如下图。若一段时间后Y电极上有3.2 g红色物质析出,停止电解。下列说法正确的是

A. a为铅蓄电池的负极
B. 电解结束时,左侧溶液质量增重4g
C. 铅蓄电池工作时正极电极反应式为:PbSO4+2e-=Pb+SO42-
D. 电解过程中,铅蓄电池的负极增重15.15g
【答案】B
【解析】A、惰性电极电解CuSO4溶液,阴极Cu2+放电析出Cu,阳极为水电离出的OH—放电生成O2。Y电极上有3.2g红色物质析出,则m(Cu)=3.2g,n(Cu)=0.05mol。所以Y电极为阴极,与阴极相连的为负极,即b为负极,故A错误;B、右侧(Y)析出0.05molCu,则整个电路中转移电子的物质的量为n(e﹣)=0.1mol,右侧Cu2+减少0.05mol,根据溶液电中性原理,右侧会有0.05molSO42—通过阴离子交换膜进入左侧,m(SO42-)=0.05mol×96g/mol=4.8g;X电极为阳极,左侧(X) 电极反应为2H2O-4e-=O2↑+4H+,右侧放出氧气,n(O2)=0.025mol,m(O2)=0.025mol×32g/mol=0.8g,所以左侧溶液质量增加为4.8g﹣0.8g=4g,故B正确;C、铅蓄电池正极为PbO2,放电时正极电极反应为 4H++PbO2+2e﹣+SO42﹣=PbSO4↓+2 H2O,故C错误;D、铅蓄电池负极为Pb,放电时电极反应为Pb-2e﹣+SO42﹣=PbSO4↓,电极增加的质量为SO42-的质量,电路中转移0.1mol,则负极增加0.05mol SO42-,m(SO42-)=4.8g,即电解过程中,铅蓄电池的负极增重4.8g,故D错误。故选B。

 阅读快车系列答案
阅读快车系列答案【题目】为实现下列实验目的,下表提供的主要仪器和所用试剂合理的是( )
选项 | 实验目的 | 主要仪器 | 所用试剂 |
A | 提纯混有MgCl2杂质的AlCl3溶液 | 烧杯、分液漏斗、胶头滴管、铁架台 | 待提纯的AlCl3溶液、NaOH溶液 |
B | 检验NH4Cl固体中的阳离子 | 试管、酒精灯 | NH4Cl固体、红色石蕊试纸、蒸馏水 |
C | 实验室制取CO2 | 试管、带导管的橡胶塞 | 大理石、稀硫酸 |
D | 测定FeSO4溶液的浓度 | 酸式滴定管、锥形瓶、 烧杯 | 0.100 mol·L-1 KMnO4标准溶液、FeSO4溶液 |
A. A B. B C. C D. D
【题目】2017年5月18日中共中央国务院公开致电祝贺南海北部神狐海域进行的“可燃冰”试采成功。“可燃冰”是天然气水合物,外形像冰,在常温常压下迅速分解释放出甲烷,被称为未来新能源。
(1)“可燃冰”作为能源的优点是__________(回答一条即可)。
(2)甲烷自热重整是先进的制氢方法,包含甲烷氧化和蒸汽重整两个过程。向反应系统同时通入甲烷,氧气和水蒸气,发生的主要化学反应如下:
反应过程 | 化学方程式 | 焓变△H(kJ.mol-l) | 活化能E.(kJ.mol-1) |
甲烷氧化 | CH4(g)+O2(g) | -802.6 | 125.6 |
CH4(g)+O2(g) | -322.0 | 172.5 | |
蒸气重整 | CH4(g)+H2O(g) | +206.2 | 240.1 |
CH4(g)+2H2O(g) | +158.6 | 243.9 |
回答下列问题:
①在初始阶段,甲烷蒸汽重整的反应速率______(填“大于”“小于”或“等于”)甲烷氧化的反应速率。
②反应CH4(g)+H2O(g)![]() CO(g)+3H2(g)的平衡转化率与温度、压强关系[其中n(CH4):n(H2O)=1:1]如图所示。
CO(g)+3H2(g)的平衡转化率与温度、压强关系[其中n(CH4):n(H2O)=1:1]如图所示。
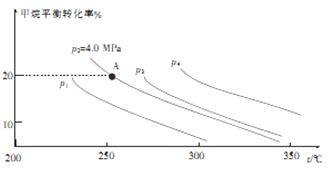
该反应在图中A点的平衡常数Kp=________(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数),图中压强(p1、p2、p3、p4)由大到小的顺序为___________。
③从能量角度分析,甲烷自热重整方法的先进之处在于___________。
④如果进料中氧气量过大,最终会导致H2物质量分数降底,原因是__________。
(3)甲烷超干重整CO2技术可得到富含CO的气体,其能源和开境上的双重意义重大,甲烷超干重整CO2的催化转化原理如图所示。
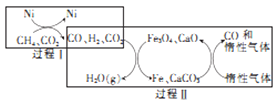
①过程II中第二步反应的化学方程式为_____________。
②只有过程I投料比![]() _______,过程II中催化剂组成才会保持不变。
_______,过程II中催化剂组成才会保持不变。
③该技术总反应的热化学方程式为______________。
