题目内容
【题目】淀粉溶液是一种胶体,并且淀粉遇到碘单质,可以出现明显的蓝色特征.现将淀粉和稀Na2SO4溶液混合,装在半透膜中,浸泡在盛蒸馏水的烧杯内,过一段时间后,取烧杯中的液体进行下列实验,能证明半透膜完好无损的是( )
A.加入BaCl2溶液产生白色沉淀
B.加入碘水不变蓝
C.加入BaCl2溶液没有白色沉淀产生
D.加入碘水变蓝
【答案】B
【解析】解:因淀粉是胶体,不能透过半透膜,则只要袋子不破损,淀粉就不会出来,加入碘水就不变蓝,故选B.

 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案【题目】2017年5月18日中共中央国务院公开致电祝贺南海北部神狐海域进行的“可燃冰”试采成功。“可燃冰”是天然气水合物,外形像冰,在常温常压下迅速分解释放出甲烷,被称为未来新能源。
(1)“可燃冰”作为能源的优点是__________(回答一条即可)。
(2)甲烷自热重整是先进的制氢方法,包含甲烷氧化和蒸汽重整两个过程。向反应系统同时通入甲烷,氧气和水蒸气,发生的主要化学反应如下:
反应过程 | 化学方程式 | 焓变△H(kJ.mol-l) | 活化能E.(kJ.mol-1) |
甲烷氧化 | CH4(g)+O2(g) | -802.6 | 125.6 |
CH4(g)+O2(g) | -322.0 | 172.5 | |
蒸气重整 | CH4(g)+H2O(g) | +206.2 | 240.1 |
CH4(g)+2H2O(g) | +158.6 | 243.9 |
回答下列问题:
①在初始阶段,甲烷蒸汽重整的反应速率______(填“大于”“小于”或“等于”)甲烷氧化的反应速率。
②反应CH4(g)+H2O(g)![]() CO(g)+3H2(g)的平衡转化率与温度、压强关系[其中n(CH4):n(H2O)=1:1]如图所示。
CO(g)+3H2(g)的平衡转化率与温度、压强关系[其中n(CH4):n(H2O)=1:1]如图所示。
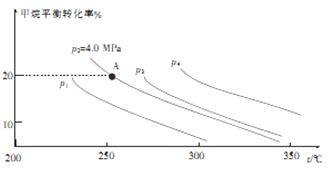
该反应在图中A点的平衡常数Kp=________(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数),图中压强(p1、p2、p3、p4)由大到小的顺序为___________。
③从能量角度分析,甲烷自热重整方法的先进之处在于___________。
④如果进料中氧气量过大,最终会导致H2物质量分数降底,原因是__________。
(3)甲烷超干重整CO2技术可得到富含CO的气体,其能源和开境上的双重意义重大,甲烷超干重整CO2的催化转化原理如图所示。
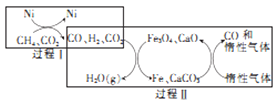
①过程II中第二步反应的化学方程式为_____________。
②只有过程I投料比![]() _______,过程II中催化剂组成才会保持不变。
_______,过程II中催化剂组成才会保持不变。
③该技术总反应的热化学方程式为______________。
【题目】Ⅰ.实验是化学研究的一种重要手段,现有下图所示A-G七种仪器,请根据要求填空。
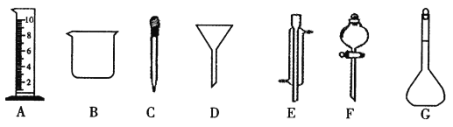
(1)写出仪器名称:E_____________,F_____________。
(2)上述仪器中实验之前需检查装置是否会漏水的是______________(填仪对应字母)。
(3)下列实验操作中用到仪器D的是_________(选填下列选项的编号字母 )。
A.分离水和CCl4的混合物 B.分离水和酒精的混合物 C.分离水和泥砂的混合物
Ⅱ.某课外兴趣小组需要200 mL1 mol/L的Na2CO3溶液,请回答下列问题:
(1)配制溶液所需仪器及药品:
应称取Na2CO3的质量______(g) | 应选用容量瓶的规格 _______(mL) | 除容量瓶外还需要的其它玻璃仪器是上图中的量筒、烧杯、_____(填仪器名称)及玻璃棒 |
(2)配制时,其正确的操作顺序是(用字母表示,每个操作只能用一次)______________。
A.将已冷却的溶液沿玻璃棒注入容量瓶中
B.用托盘天平准确称量所需Na2CO3的质量,倒入烧杯中,再加入适量水,用玻璃棒慢慢搅动,使其溶解(必要时可加热)
C.用适量水洗涤烧杯2~3次,洗涤液均注入容量瓶中,振荡
D.改用胶头滴管加水,使溶液凹液面恰好与刻度线相切
E.将容量瓶盖紧,振荡,摇匀
F.继续往容量瓶内小心加水,直到液面接近刻度1~2 cm处
(3)若出现如下情况,对所配溶液浓度将有何影响 (填“偏高”、“偏低”或“无影响”)?
没有进行C操作________;配制溶液时,容量瓶未干燥_________;定容时俯视刻度线_________。
(4)在实验操作的摇匀过程中,不慎洒出几滴,此时应采取的措施是_______________。