题目内容
2.有5瓶白色固体试剂,分别是BaCl2,NaOH,NaCl,CuSO4,Na2SO4.现进行下列实验.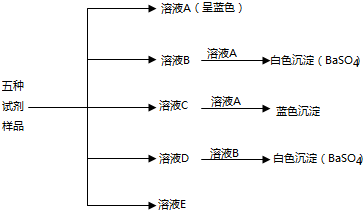
请回答下列问题:
(1)写出各溶液中溶质的化学式:ACuSO4,BBaCl2,CNaOH,DNa2SO4,ENaCl.
(2)写出溶液A与溶液B混合后发生反应的化学方程式:CuSO4+BaCl2=BaSO4↓+CuCl2.
分析 BaCl2,NaOH,NaCl,CuSO4,Na2SO4中,溶液为蓝色的是CuSO4,所以A是CuSO4,和硫酸铜反应生成白色沉淀硫酸钡的是BaCl2,所以B是BaCl2,和硫酸铜反应生成蓝色沉淀的是NaOH,所以C是NaOH,和氯化钡沉淀白色沉淀硫酸钡的是Na2SO4,所以D是Na2SO4,E为NaCl,根据物质的性质来回答.
解答 解:(1)BaCl2,NaOH,NaCl,CuSO4,Na2SO4中,溶液为蓝色的是CuSO4,所以A是CuSO4,和硫酸铜反应生成白色沉淀硫酸钡的是BaCl2,所以B是BaCl2,和硫酸铜反应生成蓝色沉淀的是NaOH,所以C是NaOH,和氯化钡沉淀白色沉淀硫酸钡的是Na2SO4,所以D是Na2SO4,E为NaCl,故答案为:CuSO4;BaCl2;NaOH;Na2SO4;NaCl.
(2)溶液A硫酸铜与溶液B氯化钡混合后发生反应的化学方程式为:CuSO4+BaCl2=BaSO4↓+CuCl2,故答案为:CuSO4+BaCl2=BaSO4↓+CuCl2.
点评 本题是一道物质的鉴别和检验知识的考查题,注意物质的性质是关键,难度中等.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
12.设NA代表阿伏加德罗常数,下列叙述正确的是( )
| A. | 标准状况下2.24 L己烷中,分子数为0.1NA | |
| B. | 22.4 L Cl2含有Cl-Cl键数为NA | |
| C. | 常温常压下16 g O2和O3混合气体中,氧原子数为NA | |
| D. | 7.8 g Na2O2与足量水反应,转移电子数为0.2NA |
10.下列过程一定需要通电才能进行的是( )
①电离 ②电镀 ③电解 ④电化学防护 ⑤电泳 ⑥电化学腐蚀.
①电离 ②电镀 ③电解 ④电化学防护 ⑤电泳 ⑥电化学腐蚀.
| A. | 全部 | B. | ②④⑤ | C. | ②③⑤ | D. | ②③④⑥ |
17.下列说法中正确的是( )
| A. | 任何化学反应都能设计成原电池 | |
| B. | 原电池两极均发生氧化还原反应 | |
| C. | 原电池中的阳离子向负极移动 | |
| D. | 将锌片和铜片用导线连接置于同一稀硫酸中,若锌片、铜片同时有气泡冒出,则说明锌片不纯 |
14.一定量的SO3中含有1.806×1023个氧原子,其物质的量为( )
| A. | 0.1mol | B. | 0.3mol | C. | 1mol | D. | 3mol |
12.分别对只含前者溶质的溶液作如下处理,溶液中离子总数目不会减少的是(忽略离子的微弱水解)( )
| A. | 含1mol碳酸氢钠溶液中加入1mol氢氧化钠 | |
| B. | 含1mol碳酸钙悬浊液中加入1mol碳酸钠固体 | |
| C. | 含2mol溴化亚铁溶液中通入3mol氯气 | |
| D. | 含3mol Na2SO3溶液中通入2mol NO2 |
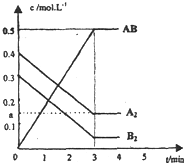 在一个容积为2L的密闭容器中,加入0.8mol的A2气体和0.6molB2气体,一定条件下发生如下反应:A2(g)+B2(g)?2AB(g)△H<0,反应中各物质的浓度随时间的变化情况如图所示.
在一个容积为2L的密闭容器中,加入0.8mol的A2气体和0.6molB2气体,一定条件下发生如下反应:A2(g)+B2(g)?2AB(g)△H<0,反应中各物质的浓度随时间的变化情况如图所示.