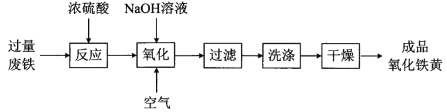
题目内容
【题目】将一定质量的镁铜合金加入到稀硝酸中,两者恰好完全反应,假设反应过程中还原产物全是NO,向所得溶液中加入物质的量浓度为3 mol·L-1的NaOH溶液至沉淀完全,测得生成沉淀的质量比原合金的质量增加5.1 g,则下列有关叙述中正确的是
A.加入合金的质量不可能为8.8 g
B.被还原的硝酸的物质的量为0.4 mol
C.沉淀完全时消耗NaOH溶液的体积为150 mL
D.溶解合金时收集到NO气体的体积在标准状况下约为2.24 L
【答案】D
【解析】
将镁和铜组成的混合物加入到稀HNO3中,金属完全溶解(假设反应中还原产物只有NO),发生反应:3Mg+8HNO3(稀)=3Mg(NO3)2+2NO↑+4H2O、3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O,向反应后的溶液中加入过量的3mol·L-1 NaOH溶液至沉淀完全,发生反应:Mg(NO3)2+2NaOH=Mg(OH)2↓+2NaNO3、Cu(NO3)2+2NaOH=Cu(OH)2↓+2NaNO3,沉淀为氢氧化镁和氢氧化铜,生成沉淀的质量比原合金的质量增加5.1g,则氢氧化镁和氢氧化铜含有氢氧根的质量为5.1g,氢氧根的物质的量为:n(OH-)=![]() =0.3mol,根据反应方程式可知,镁和铜的总的物质的量为:n=
=0.3mol,根据反应方程式可知,镁和铜的总的物质的量为:n=![]() ×n(OH-)=0.15mol。
×n(OH-)=0.15mol。
A.根据反应方程式Mg(NO3)2+2NaOH=Mg(OH)2↓+2NaNO3、Cu(NO3)2+2NaOH=Cu(OH)2↓+2NaNO3可知,镁和铜的总的物质的量为铜离子物质的量的一半,即:![]() =0.15mol,假定全为镁,金属质量为0.15mol×24g·mol-1=3.6g,若全为铜,金属质量为:0.15mol×64g·mol-1=9.6g,所以参加反应的金属的总质量(m)范围为:3.6g<m<9.6g,则金属质量可能为8.8g,故A错误;
=0.15mol,假定全为镁,金属质量为0.15mol×24g·mol-1=3.6g,若全为铜,金属质量为:0.15mol×64g·mol-1=9.6g,所以参加反应的金属的总质量(m)范围为:3.6g<m<9.6g,则金属质量可能为8.8g,故A错误;
B.n还原(HNO3)=![]() n(金属)=
n(金属)=![]() ×0.15mol=0.1mol,故B错误;
×0.15mol=0.1mol,故B错误;
C.反应消耗氢氧化钠的物质的量为:n(NaOH)=n(OH-)=0.3mol,则加入的氢氧化钠溶液的体积为:V=![]() =0.1L=100mL,故C错误;
=0.1L=100mL,故C错误;
D.金属的物质的量为0.15mol,完全反应失去0.15mol×2=0.3mol电子,根据电子转移守恒,生成一氧化氮的物质的量为:n(NO)=![]() =0.1mol,标准状况下0.1molNO的体积为2.24L,故D正确;
=0.1mol,标准状况下0.1molNO的体积为2.24L,故D正确;
故选D。