题目内容
【题目】氢气是一种重要的工业原料和清洁能源,可用作合成氨、合成甲醇、合成盐酸的原料,冶金用还原剂等。
(1)已知:CH4(g)+H2O(g)![]() CO(g)+3H2(g) ΔH=+206.2 kJ·mol1。
CO(g)+3H2(g) ΔH=+206.2 kJ·mol1。
CH4(g)+CO2(g)![]() 2CO(g)+2H2(g) ΔH=+247.4 kJ·mol1
2CO(g)+2H2(g) ΔH=+247.4 kJ·mol1
则反应CH4(g)+2H2O(g)![]() CO2(g)+4H2(g) ΔH= _______kJ·mol1。
CO2(g)+4H2(g) ΔH= _______kJ·mol1。
(2)工业合成氨的反应原理为N2(g)+3H2(g)![]() 2NH3(g) ΔH=92.4 kJ·mol1。
2NH3(g) ΔH=92.4 kJ·mol1。
①该反应中的H2制取成本较高,工业生产中往往追求H2的转化率。增大H2的平衡转化率的措施有_______(填字母代号)。
a.增大压强
b.升高温度
c.增大N2浓度
d.及时移走生成物NH3
e.使用高效催化剂
②升高温度,该可逆反应的平衡常数K__________(填“增大”“不变”或“减小”)。
③某温度下,把10 mol N2与28 mol H2置于容积为10 L的恒容密闭容器内,10 min时反应达到平衡状态,测得平均速率v(NH3)=0.12 mol·L1·min1,H2的平衡转化率为_______(保留三位有效数字),则该温度下反应的平衡常数K=_______。
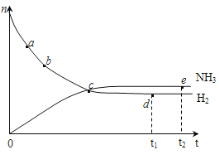
(3)下图所示装置工作时均与H2有关。
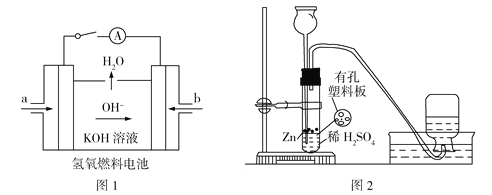
①图l所示装置,通入H2的管口是______(填字母),正极反应式为___________________。
②图2是实验室制备H2的实验装置,在漏斗中加入1 mL CuSO4溶液,可观察到气泡生成速率明显加快,原因是_____________________,若反应装置中硫酸过量,则加入CuSO4溶液后,生成的氢气量__________(填“增大”“不变”或“减小”)。
【答案】+165.0 acd 减小 64.3% 3.6 mol2·L2 b O2+2H2O+4e![]() 4OH Zn还原出Cu,Cu、Zn与硫酸形成原电池 减小
4OH Zn还原出Cu,Cu、Zn与硫酸形成原电池 减小
【解析】
(1)利用盖斯定律,使第一个热化学方程式乘2,然后减去第二个热化学方程式,可得新的热化学方程式CH4(g)+2H2O(g)=CO2(g)+4H2(g) ΔH=+165.0 kJ·mol1。
(2)①N2(g)+3H2(g)![]() 2NH3(g) ΔH=92.4 kJ·mol1,该反应为气体物质的量减小、放热的反应,故增大压强,降低温度,可使平衡正向移动,H2转化率提高;增大一种反应物的浓度,可提高另外反应物的转化率;及时移走生成物,可使平衡正向移动,反应物转化率提高;催化剂只能提高反应速率,不能改变化学平衡,答案选acd。
2NH3(g) ΔH=92.4 kJ·mol1,该反应为气体物质的量减小、放热的反应,故增大压强,降低温度,可使平衡正向移动,H2转化率提高;增大一种反应物的浓度,可提高另外反应物的转化率;及时移走生成物,可使平衡正向移动,反应物转化率提高;催化剂只能提高反应速率,不能改变化学平衡,答案选acd。
②该反应为放热反应,故升温平衡逆向移动,平衡常数减小。
③平衡生成的n(NH3)为0.12 mol·L1·min1×10 L×10 min=12 mol,故消耗的H2为18 mol,其转化率为18 mol/28 mol×100%=64.3%;平衡时,c(N2)=(10 mol 6 mol)/10 L=0.4 mol/L,c(H2)=(28 mol18 mol)/10 L=1 mol/L,c(NH3)=12 mol/10 L=1.2 mol/L,平衡常数K=![]() =
=![]() =3.6 (mol2·L2)。
=3.6 (mol2·L2)。
(3)①由图1中OH移动方向可知b为负极,是H2发生氧化反应的电极;正极为O2得电子与水反应生成OH,电极反应式为O2+2H2O+4e=4OH;
②加入CuSO4后,Cu2+与Zn发生置换反应生成Cu,Cu、Zn与硫酸形成原电池,使生成H2的速率加快。由于部分Zn参与置换反应,故生成氢气的量减小。