题目内容
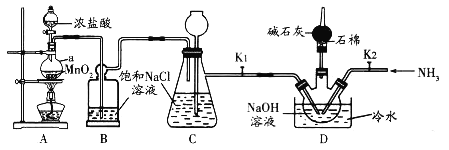
【题目】肼(![]() ,无色液体)是一种用途广泛的化工原料。实验室中先制备次氯酸钠,再用次氯酸钠溶液和氨反应制备肼并验证肼的性质。实验装置如图所示。
,无色液体)是一种用途广泛的化工原料。实验室中先制备次氯酸钠,再用次氯酸钠溶液和氨反应制备肼并验证肼的性质。实验装置如图所示。
已知:![]()
![]() 。当温度超过40℃时,
。当温度超过40℃时,![]() 与
与![]() 溶液反应生成
溶液反应生成![]() 。
。
回答下列问题:
(1)装置B的作用是______________。
(2)为控制D装置中的反应温度,除用冷水浴外,还需采取的实验操作是_________。
(3)当三颈烧瓶中出现黄绿色气体时立即关闭分液漏斗活塞、移去酒精灯、关闭![]() 。此时装置C的作用是_______________。
。此时装置C的作用是_______________。
(4)将D装置水槽中的冷水换为热水,把三颈烧瓶中黄绿色气体赶走后,打开![]() ,通入
,通入![]() ,使其与
,使其与![]() 溶液反应制取肼。理论上通入三颈烧瓶的
溶液反应制取肼。理论上通入三颈烧瓶的![]() 和
和![]() 的最佳物质的量之比为______。
的最佳物质的量之比为______。
(5)请从提供的下列试剂中选择合适试剂,设计合理的实验方案验证肼的还原性(说明操作、现象和结论)。____________。
①淀粉-![]() 溶液 ②稀硫酸(酚酞) ③
溶液 ②稀硫酸(酚酞) ③![]() ④
④![]()
【答案】除去![]() 中的
中的![]() 控制浓盐酸的滴加速度或控制A处加热温度 储存氯气
控制浓盐酸的滴加速度或控制A处加热温度 储存氯气 ![]() 取少量
取少量![]() 于试管中,加入肼溶液,固体逐渐变黑,并有气泡产生,说明肼有还原性。
于试管中,加入肼溶液,固体逐渐变黑,并有气泡产生,说明肼有还原性。
【解析】
(1)A中制取的Cl2中含有HCl,应用饱和氯化钠除去;
(2)由已知条件可知,过量的氯气和氢氧化钠反应是放热反应,所以可以控制氯气的产生速率达到降温的目的;
(3)关闭分液漏斗活塞、移去酒精灯时,A中的反应并未立即停止,还会继续产生Cl2,关闭K1,A、B是密闭体系,C起到储气瓶的作用;
(4)氯气通入D中,发生反应:Cl2![]() 2NaOH=NaCl
2NaOH=NaCl![]() NaClO
NaClO![]() H2O,通入氨气后发生反应:NaClO
H2O,通入氨气后发生反应:NaClO![]() 2NH3=N2H4
2NH3=N2H4![]() NaCl
NaCl![]() H2O,通过两个方程式可以找到通入Cl2和NH3物质的量之比;
H2O,通过两个方程式可以找到通入Cl2和NH3物质的量之比;
(5)要证明N2H4的还原性,需要用有氧化性的物质与其反应。
(1)A中制取的Cl2中含有HCl,B中盛有饱和氯化钠,用以除去HCl;
本题答案为:除去Cl2中的HCl。
(2)由已知条件可知,过量的氯气和氢氧化钠反应是放热反应,所以可以控制氯气的产生速率达到降温的效果,控制浓盐酸的滴加速度或控制A处加热温度,可控制Cl2产生速率,以免过量氯气和氢氧化钠反应;
本题答案为:控制浓盐酸的滴加速度或控制A处加热温度。
(3)关闭分液漏斗活塞、移去酒精灯时,A中的反应并未立即停止,还会继续产生Cl2,关闭K1,A、B装置是密闭体系,C起到储气瓶的作用;
本题答案为:储存氯气。
(4)氯气通入D中,发生反应:Cl2![]() 2NaOH=NaCl
2NaOH=NaCl![]() NaClO
NaClO![]() H2O,通入氨气后发生反应:NAClO
H2O,通入氨气后发生反应:NAClO![]() 2NH3=N2H4
2NH3=N2H4![]() NaCl
NaCl![]() H2O,通过两个方程式可以知道,理论上通入三颈烧瓶的
H2O,通过两个方程式可以知道,理论上通入三颈烧瓶的![]() 和
和![]() 的最佳物质的量之比为:1:2;
的最佳物质的量之比为:1:2;
本题答案为:1:2。
(5)要验证肼的还原性,则需要选择氧化剂,AgCl中Ag+具有氧化性,故选择AgCl,操作现象及结论为:取少量AgCl于试管中,加入肼溶液,固体逐渐变黑,并有气泡产生,说明肼有还原性;
本题答案为:取少量![]() 于试管中,加入肼溶液,固体逐渐变黑,并有气泡产生,说明肼有还原性。
于试管中,加入肼溶液,固体逐渐变黑,并有气泡产生,说明肼有还原性。