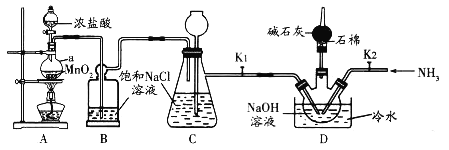
题目内容
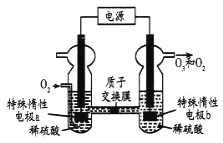
【题目】![]() 是一种常见的绿色氧化剂,可由臭氧发生器(原理如图)电解稀硫酸制得。下列说法错误的是
是一种常见的绿色氧化剂,可由臭氧发生器(原理如图)电解稀硫酸制得。下列说法错误的是
A. 电极a为阴极
B. 标准状况下,当![]() 反应时收集到
反应时收集到![]() 和
和![]() 混合气体
混合气体![]() ,
,![]() 的体积分数为80%
的体积分数为80%
C. 电解一段时间后b极周围的![]() 下降
下降
D. a极的电极反应为![]()
【答案】B
【解析】
观察电解池装置图,电解池左侧通入氧气,由此可知a极发生还原反应,a极为阴极,电极反应式为:O2![]() 4H+
4H+![]() 4e-=2H2O,所以b做阳极,以此分析即可。
4e-=2H2O,所以b做阳极,以此分析即可。
A.电解池左侧通入氧气,由此可知a极发生还原反应,a极为阴极,故A正确;
B.由O2![]() 4H+
4H+![]() 4e-=2H2O,可知阴极有5.6LO2(0.25mol),反应时,转移电子数为1mol,在阳极收集到气体的物质的量为0.2mol,设O2mmol,O3nmol,依据电子转移守恒有:4m
4e-=2H2O,可知阴极有5.6LO2(0.25mol),反应时,转移电子数为1mol,在阳极收集到气体的物质的量为0.2mol,设O2mmol,O3nmol,依据电子转移守恒有:4m![]() 6y=1,m
6y=1,m![]() n=0.2,联立解得m=0.1,n=0.1,故O3的体积分数为0.1/0.2
n=0.2,联立解得m=0.1,n=0.1,故O3的体积分数为0.1/0.2![]() 100
100![]() =50
=50![]() ,故B错误;
,故B错误;
C.b极水电离出的OH-失去电子,生成O2和O3,电解一段时间后,水的电离平衡被破坏,溶液的c(H+)增大,pH下降,故C正确;
D.由上述分析可知,a极的电极反应为:O2![]() 4H+
4H+![]() 4e-=2H2O,故D正确;
4e-=2H2O,故D正确;
本题答案为B。

练习册系列答案
相关题目
【题目】由下列实验及现象能推出相应结论的是( )
实验 | 现象 | 结论 | |
A | 将 | 溶液变为血红色 |
|
B | 向 | 生成白色沉淀 | 非金属性 |
C | 向盛有 | 溴水褪色 | 还原性: |
D | 向无色溶液中滴入 | 有白色沉淀生成 | 无色溶液中一定含 |
A. A B. B C. C D. D