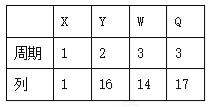
题目内容
【题目】以NaBH4和H2O2作原料的燃料电池,可用作空军通信卫星。电池负极材料采用Pt/C,正极材料采用MnO2,其工作原理如下图所示。下列说法错误的是

A. 电池放电时Na+从a极区移向b极区
B. 电极b采用Pt/C,该极溶液的pH增大
C. 该电池a极的反应为BH4-+8OH--8e-===BO2-+6H2O
D. 电池总反应:BH4- + 4H2O2 === BO2- + 6H2O
【答案】B
【解析】分析:在原电池中,正极:化合价降低,发生还原反应;负极:化合价升高,发生氧化反应;在a极:BH4-+8OH--8e-=BO2-+6H2O,在b极:H202+2e-+2H+=2H2O,据此可判断a极为负极,b极为正极;
详解:A、电池放电时,原电池中的阳离子向正极移动,所以Na+从a极移向b极,故A正确;
B、b极为正极,正极材料是MnO2,不是Pt/C,故B错误;
C、a极发生氧化反应:BH4-+8OH--8e-=BO2-+6H2O,,故C正确;
D、电池总反应:BH4- + 4H2O2 === BO2- + 6H2O,故D正确;
故选B。

练习册系列答案
相关题目