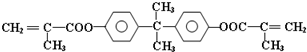
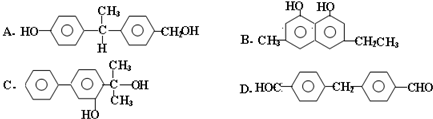
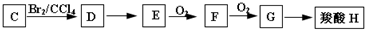题目内容
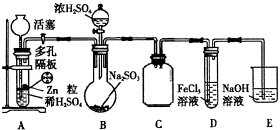
13.用试纸检验气体性质是一种重要的实验方法.如表所示的实验中(可加热),下列试纸的选用、现象、对应结论都正确的一项是( )| 序号 | 试剂B | 湿润的试纸A | 结论 |
| A | 碘水 | 淀粉试纸变蓝 | 碘具有氧化性 |
| B | 浓氨水、生石灰 | 蓝色石蕊试纸变红 | 氨气为碱性气体 |
| C | Na2SO3、硫酸 | 品红试纸褪色 | SO2具有漂白性 |
| D | Cu、浓硝酸 | 淀粉KI试纸变蓝 | NO2为酸性气体 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.淀粉遇碘单质变蓝;
B.浓氨水与生石灰反应制取氨气,检验氨气选红色湿润试纸;
C.Na2SO3与硫酸反应生成二氧化硫,二氧化硫与品红化合生成无色物质;
D.Cu与浓硝酸反应生成二氧化氮,二氧化氮与KI发生氧化还原反应生成碘.
解答 解:A.碘水中含碘单质,淀粉遇碘单质变蓝,为淀粉的特性,与碘的氧化性无关,故A错误;
B.浓氨水与生石灰反应制取氨气,检验氨气选红色湿润试纸,红色变为蓝色可检验氨气,故B错误;
C.Na2SO3与硫酸反应生成二氧化硫,二氧化硫与品红化合生成无色物质,说明二氧化硫具有漂白性,故C正确;
D.Cu与浓硝酸反应生成二氧化氮,二氧化氮与KI发生氧化还原反应生成碘,淀粉遇碘单质变蓝,说明NO2为氧化性气体,故D错误;
故选C.
点评 本题考查化学实验方案的评价,为高频考点,涉及物质的性质、检验及氧化还原反应的应用等,把握物质的性质、反应原理为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
4.下列叙述从化学角度分析,其中正确的是( )
| A. | 相同物质的量的烃,完全燃烧,生成的CO2越多,说明烃中的碳的质量分数越大 | |
| B. | 相同质量的烃,完全燃烧,消耗的O2越多,说明烃中的氢的质量分数越大 | |
| C. | 银镜反应实验后试管内壁附有银,可用氨水清洗 | |
| D. | 氟利昂(CF2Cl2)或氮氧化物(NOx)气体会破坏大气臭氧层,从而导致“温室效应” |
1.下列说法正确的是( )
| A. | 反应热就是反应中放出的能量 | |
| B. | 在101 kPa时,1mol碳燃烧所放出的热量为碳的燃烧热 | |
| C. | 等量的硫蒸气和硫固体分别完全燃烧,前者放出的热量少 | |
| D. | 由C(石墨)═C(金刚石)△H=+1.9 kJ•mol-1可知,石墨稳定 |
18.下列各组微粒按氧化性由弱到强,半径由大到小的顺序排列的是( )
| A. | O、Cl、S、P | B. | K+、Mg2+、Al3+、H+ | ||
| C. | Ca2+、Mg2+、Al3+、K+ | D. | I-、Br-、Cl-、F- |
5.盛放下列试剂的试剂瓶不能用玻璃塞的是( )
| A. | 氢氧化钠溶液 | B. | 盐酸 | C. | 硫酸钠溶液 | D. | AgNO3溶液 |
16.有机物:①正丁烷 ②异丁烷 ③正戊烷 ④异戊烷,它们的沸点按由高到低的顺序排列正确的是( )
| A. | ①>②>③>④ | B. | ③>④>①>② | C. | ③>①>④>② | D. | ④>③>②>① |