题目内容
16.有机物:①正丁烷 ②异丁烷 ③正戊烷 ④异戊烷,它们的沸点按由高到低的顺序排列正确的是( )| A. | ①>②>③>④ | B. | ③>④>①>② | C. | ③>①>④>② | D. | ④>③>②>① |
分析 烷烃都是分子晶体,其熔沸点与相对分子质量成正比,所以烷烃中,碳原子个数越多,其熔沸点越高,如果碳原子个数相等,支链越少,熔沸点越高,据此分析解答.
解答 解:烷烃都是分子晶体,其熔沸点与相对分子质量成正比,所以烷烃中,碳原子个数越多,其熔沸点越高,如果碳原子个数相等,支链越少,熔沸点越高,①②③④中碳原子个数分别是4、4、5、5,①③中不含支链、②④中含有支链,所以熔沸点高低顺序是③>④>①>②,
故选B.
点评 本题考查烷烃熔沸点高低判断,明确分子晶体熔沸点与相对分子质量关系、烷烃熔沸点与碳原子个数及支链关系即可解答,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
13.用试纸检验气体性质是一种重要的实验方法.如表所示的实验中(可加热),下列试纸的选用、现象、对应结论都正确的一项是( )
| 序号 | 试剂B | 湿润的试纸A | 结论 |
| A | 碘水 | 淀粉试纸变蓝 | 碘具有氧化性 |
| B | 浓氨水、生石灰 | 蓝色石蕊试纸变红 | 氨气为碱性气体 |
| C | Na2SO3、硫酸 | 品红试纸褪色 | SO2具有漂白性 |
| D | Cu、浓硝酸 | 淀粉KI试纸变蓝 | NO2为酸性气体 |
| A. | A | B. | B | C. | C | D. | D |
14.下列除去杂质的方法正确的是( )
| A. | KNO3溶液中混有少量K2SO4,加入适量BaCl2溶液 | |
| B. | 二氧化碳气体中混有少量二氧化硫:通入酸性高锰酸钾溶液,收集气体 | |
| C. | 除去FeCl2溶液中混有的FeCl3:加入过量铁粉,过滤 | |
| D. | 除去Cu粉中混有的CuO:加适量稀硝酸后,过滤、洗涤 |
11.阿司匹林( 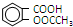 )是世界上应用最广泛的解热、镇痛药.因乙酸很难与酚羟基酯化,工业上以水杨酸(
)是世界上应用最广泛的解热、镇痛药.因乙酸很难与酚羟基酯化,工业上以水杨酸( 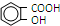 )与乙酸酐[(CH3CO)2O]为主要原料合成阿司匹林.粗产品中主要的副产物是水杨酸多聚物,需进一步提纯.反应原理和相关物理数据如下:
)与乙酸酐[(CH3CO)2O]为主要原料合成阿司匹林.粗产品中主要的副产物是水杨酸多聚物,需进一步提纯.反应原理和相关物理数据如下:
 +(CH3CO)2O$?_{△}^{浓硫酸}$
+(CH3CO)2O$?_{△}^{浓硫酸}$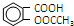 +CH3COOH
+CH3COOH
如图1是工业上制备并提纯阿司匹林的部分流程:
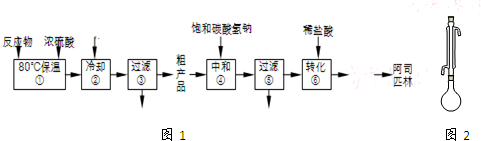
完成下列填空:
(1)步骤①的反应装置如图2所示(加热装置未画出),实验仪器必须干燥的原因是防止乙酸酐与水反应生成乙酸,不利于反应发生;冷凝管的作用是冷凝回流;对烧瓶进行加热的合适方法是水浴加热.
(2)反应中加入的乙酸酐是过量的,过量的目的是提高水杨酸的转化率;步骤②中加入水的目的是使乙酸酐转化为乙酸,同时放出大量的热,需冷却至常温再进行过滤,冷却的目的是减少阿司匹林因溶解而损失(使阿司匹林结晶析出);检验步骤③所得滤液中是否含有水杨酸,可选用的试剂是FeCl3.(写化学式)
(3)步骤④中加入NaHCO3的目的是使阿司匹林转化为易溶于水的盐.
(4)步骤⑤过滤得到的滤渣主要是水杨酸多聚物.步骤⑥中加入盐酸后发生反应的化学方程式为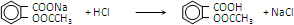 .
.
(5)从步骤⑥到成品纯阿司匹林的剩余操作依次有结晶、过滤、洗涤、干燥.
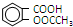 )是世界上应用最广泛的解热、镇痛药.因乙酸很难与酚羟基酯化,工业上以水杨酸(
)是世界上应用最广泛的解热、镇痛药.因乙酸很难与酚羟基酯化,工业上以水杨酸( 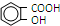 )与乙酸酐[(CH3CO)2O]为主要原料合成阿司匹林.粗产品中主要的副产物是水杨酸多聚物,需进一步提纯.反应原理和相关物理数据如下:
)与乙酸酐[(CH3CO)2O]为主要原料合成阿司匹林.粗产品中主要的副产物是水杨酸多聚物,需进一步提纯.反应原理和相关物理数据如下: +(CH3CO)2O$?_{△}^{浓硫酸}$
+(CH3CO)2O$?_{△}^{浓硫酸}$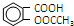 +CH3COOH
+CH3COOH| 名称 | 常温下状态 | 水中溶解性 |
| 乙酸酐 | 液 | 与水反应 |
| 阿司匹林 | 固 | 冷水中微溶;热水中易溶 |
| 水杨酸多聚物 | 固 | 难溶 |

完成下列填空:
(1)步骤①的反应装置如图2所示(加热装置未画出),实验仪器必须干燥的原因是防止乙酸酐与水反应生成乙酸,不利于反应发生;冷凝管的作用是冷凝回流;对烧瓶进行加热的合适方法是水浴加热.
(2)反应中加入的乙酸酐是过量的,过量的目的是提高水杨酸的转化率;步骤②中加入水的目的是使乙酸酐转化为乙酸,同时放出大量的热,需冷却至常温再进行过滤,冷却的目的是减少阿司匹林因溶解而损失(使阿司匹林结晶析出);检验步骤③所得滤液中是否含有水杨酸,可选用的试剂是FeCl3.(写化学式)
(3)步骤④中加入NaHCO3的目的是使阿司匹林转化为易溶于水的盐.
(4)步骤⑤过滤得到的滤渣主要是水杨酸多聚物.步骤⑥中加入盐酸后发生反应的化学方程式为
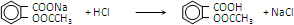 .
.(5)从步骤⑥到成品纯阿司匹林的剩余操作依次有结晶、过滤、洗涤、干燥.
1.下列解释事实的化学方程式不正确的是( )
| A. | 金属钠在空气中加热,生成淡黄色固体:2Na+O2═Na2O2 | |
| B. | 向硫酸铝溶液中加入氨水制备氢氧化铝:Al3++3NH3•H2O=Al(OH)3↓+3$N{{H}_{4}}^{+}$ | |
| C. | 铁在潮湿的环境中生锈:3Fe+4H2O=Fe3O4+H2↑ | |
| D. | 二氧化氮溶于水有硝酸生成:3NO2+H2O=2HNO3+NO |
6. 已知:3CH4(g)+2N2(g)?3C(s)+4NH3(g)△H>0,700℃时,CH4与N2在不同物质的量之比[n(CH4)/n(N2)]时CH4的平衡转化率如图所示,下列说法不正确的是( )
已知:3CH4(g)+2N2(g)?3C(s)+4NH3(g)△H>0,700℃时,CH4与N2在不同物质的量之比[n(CH4)/n(N2)]时CH4的平衡转化率如图所示,下列说法不正确的是( )
 已知:3CH4(g)+2N2(g)?3C(s)+4NH3(g)△H>0,700℃时,CH4与N2在不同物质的量之比[n(CH4)/n(N2)]时CH4的平衡转化率如图所示,下列说法不正确的是( )
已知:3CH4(g)+2N2(g)?3C(s)+4NH3(g)△H>0,700℃时,CH4与N2在不同物质的量之比[n(CH4)/n(N2)]时CH4的平衡转化率如图所示,下列说法不正确的是( )| A. | n(CH4)/n(N2)越小,CH4的转化率越高 | |
| B. | n(CH4)/n(N2)不变时,若升温,NH3的体积分数会增大 | |
| C. | b点对应的平衡常数与a点一样 | |
| D. | a点对应的NH3的体积分数约为26% |
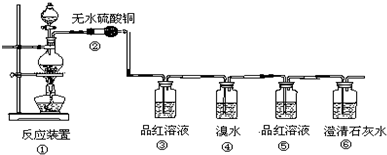
 有如下性质:
有如下性质: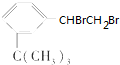 .
. SO2在物质的研究和制备过程中有重要的用途,既可以作为原料又可作为溶剂,请回答下列问题:
SO2在物质的研究和制备过程中有重要的用途,既可以作为原料又可作为溶剂,请回答下列问题: