题目内容
【题目】由硫和亚硫酸钠共热可制备硫代硫酸钠(Na2S2O3),Na2S2O3是重要的化工料,易溶于水,在酸性溶液中发生如下反应:S2O32-+2H+=S↓+SO2↑+H2O。某兴趣小组拟制备硫代硫酸钠晶体(Na2S2O3·5H2O),并测定产品的纯度。装置如下(已略去加热装置):

(1)D是尾气处理装置,盛放的溶液可以是__________。
a.酸性高锰酸钾溶液 b.NaOH溶液 c.饱和NaHSO3溶液
(2)C中发生的化学反应有:__________、2Na2S+3SO2=2Na2SO3+3S↓、__________。
(3)经过系列操作,该小组同学从C中制得了Na2S2O3·5H2O,此晶体中可能混有Na2SO3和Na2SO4杂质。接下来,他们做实验证明了则两种杂质的存在,请完成操作:取适量产品配成稀溶液,滴加足量BaCl2溶液,有白色沉淀生成,__________,沉淀未完全溶解,并有刺激性气味的气体产生(已知Ba2+与S2O32-不生成沉淀)。
(4)该组同学经讨论认为:先向A中滴加70%的H2SO4,产生的气体将装置中的空气排尽后,再向C加入Na2S和Na2CO3混合溶液,可减少装置C中生成的Na2SO4的量,画出改进后的C装置。___________

(5)测定Na2S2O3·5H2O的纯度:称取Wg产品,用适量蒸馏水溶解,滴加少量淀粉溶液,用0.1000mol·L-1碘的标准溶液滴定,反应原理为2S2O32-+I2=S4O62-+2I-。
①判断反应达到滴定至终点的标志是:______________________________。
②滴定起始和终点的液面位置如图,则产品的纯度为(Na2S2O·5H2O的摩尔质量为Mg·mol-1)____________________。

【答案】 ab Na2CO3+SO2=CO2+Na2SO3 Na2SO3+S![]() Na2S2O3。 过滤后用蒸馏水洗涤沉淀,向沉淀中加入足量稀盐酸
Na2S2O3。 过滤后用蒸馏水洗涤沉淀,向沉淀中加入足量稀盐酸 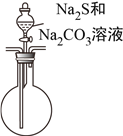 最后一滴碘液滴入时,溶液由无色变蓝色,且30s内不恢复原来的颜色
最后一滴碘液滴入时,溶液由无色变蓝色,且30s内不恢复原来的颜色 ![]() ×100%。
×100%。
【解析】本题考查实验方案设计与评价,(1)SO2是有毒气体,防止污染空气,需要进行尾气处理,利用SO2属于酸性氧化物或具有还原性,进行除去,a、酸性高锰酸钾溶液氧化SO2为SO42-,故a正确;b、SO2与NaOH反应生成Na2SO3,故b正确;c、SO2与NaHSO3不发生反应,不能除去SO2,故c错误;(2)亚硫酸的酸性强于碳酸,因此发生SO2+Na2CO3=Na2SO3+CO2,反应制备硫代硫酸钠晶体,因此发生Na2SO3+S ![]() Na2S2O3;;(3)实验证明两种杂质的存在,因为S2O32-与Ba2+不生成沉淀,但S2O32-与H+反应生成S和SO2,因此滴加BaCl2溶液有白色沉淀生成后,应过滤,排除S2O32-的干扰,然后向沉淀中加入足量的稀盐酸,沉淀未完全溶解,说明沉淀中有BaSO4,即杂质中含有Na2SO4,由刺激性气味气体产生,此气体为SO2,说明杂质中含有Na2SO3;(4)根据信息,需要先排除装置中空气,防止干扰实验,再向C中加入硫化钠和碳酸钠溶液,因此装置设计成
Na2S2O3;;(3)实验证明两种杂质的存在,因为S2O32-与Ba2+不生成沉淀,但S2O32-与H+反应生成S和SO2,因此滴加BaCl2溶液有白色沉淀生成后,应过滤,排除S2O32-的干扰,然后向沉淀中加入足量的稀盐酸,沉淀未完全溶解,说明沉淀中有BaSO4,即杂质中含有Na2SO4,由刺激性气味气体产生,此气体为SO2,说明杂质中含有Na2SO3;(4)根据信息,需要先排除装置中空气,防止干扰实验,再向C中加入硫化钠和碳酸钠溶液,因此装置设计成 ;(5)①淀粉遇到碘单质变蓝,根据反应原理,滴定至终点的标志为:最后一滴碘液滴入时,溶液由无色变蓝色,且30s内不恢复原来的颜色;②滴定中消耗I2的体积为18.10mL,根据2S2O32-+I2=S4O62-+2I-,n(Na2SO3·5H2O)=2×18.10×10-3×0.1mol,纯度为2×18.10×10-3×0.1×M/W×100%=
;(5)①淀粉遇到碘单质变蓝,根据反应原理,滴定至终点的标志为:最后一滴碘液滴入时,溶液由无色变蓝色,且30s内不恢复原来的颜色;②滴定中消耗I2的体积为18.10mL,根据2S2O32-+I2=S4O62-+2I-,n(Na2SO3·5H2O)=2×18.10×10-3×0.1mol,纯度为2×18.10×10-3×0.1×M/W×100%= ![]() ×100%。
×100%。

 夺冠金卷全能练考系列答案
夺冠金卷全能练考系列答案【题目】用浓盐酸和MnO2制取Cl2的装置如下,某小组欲证明产生的气体中含有HCl。
(1)Cl2的电子式是__________,A中反应的离子方程式为____________________。
(2)甲同学将A中产生的气体通入下列溶液:
实验序号 | 试剂 | 现象 |
a | 紫色石蕊溶液 | |
b | AgNO3 | 出现白色沉淀 |
①实验a中的现象为__________。
②不能证明产生的气体中含有HCl的实验是__________(填字母序号)
(3)已知将HCl气体通入饱和食盐水中有白色固体析出。乙同学将A中产生的气体通入饱和食盐水中,有白色固体析出,但实验不能证明气体中含有HCl,结合化学用语解释其原因:_______________________________________________________________________________
(4)已知:2S2O32-+I2=S4O62-+2I-。丙同学将A中产生的气体通入蒸馏水中,得到溶液X,进行以下实验证明气体中含有HCl。
实验I.测定X中溶解的Cl2。取25.00mL溶液X,加入过量KI溶液,然后用0.04mol·L-1Na2S2O3溶液滴定生成的I2,达滴定终点时消耗Na2S2O3溶液VmL。
实验II.测定X中Cl元素重量。另取25.00mL溶液X,选用适当的还原将溶解的Cl2全部还原为Cl-,再用0.10mol·L-1AgNO3溶液滴定说的溶液中的CI-。
①X中的HClO不会影响实验I的测定结果,原因是__________。
②由I、II中实验数据可证明A中产生的气体中含有HCl,则II中0.10mol·L-1AgNO3溶液的体积应大于__________mL(用含V的代数式表示)。
【题目】下表是常温下某些一元弱酸的电离常数:
弱酸 | HCN | HF | CH3COOH | HNO2 |
电离常数 | 6.2×10-10 | 6.8×10-4 | 1.7×10-5 | 6.4×10-6 |
则0.1 mol·L-1的下列溶液中,pH最小的是( )
A. HCN B. HF C. CH3COOH D. HNO2



