题目内容
【题目】用浓盐酸和MnO2制取Cl2的装置如下,某小组欲证明产生的气体中含有HCl。
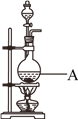
(1)Cl2的电子式是__________,A中反应的离子方程式为____________________。
(2)甲同学将A中产生的气体通入下列溶液:
实验序号 | 试剂 | 现象 |
a | 紫色石蕊溶液 | |
b | AgNO3 | 出现白色沉淀 |
①实验a中的现象为__________。
②不能证明产生的气体中含有HCl的实验是__________(填字母序号)
(3)已知将HCl气体通入饱和食盐水中有白色固体析出。乙同学将A中产生的气体通入饱和食盐水中,有白色固体析出,但实验不能证明气体中含有HCl,结合化学用语解释其原因:_______________________________________________________________________________
(4)已知:2S2O32-+I2=S4O62-+2I-。丙同学将A中产生的气体通入蒸馏水中,得到溶液X,进行以下实验证明气体中含有HCl。
实验I.测定X中溶解的Cl2。取25.00mL溶液X,加入过量KI溶液,然后用0.04mol·L-1Na2S2O3溶液滴定生成的I2,达滴定终点时消耗Na2S2O3溶液VmL。
实验II.测定X中Cl元素重量。另取25.00mL溶液X,选用适当的还原将溶解的Cl2全部还原为Cl-,再用0.10mol·L-1AgNO3溶液滴定说的溶液中的CI-。
①X中的HClO不会影响实验I的测定结果,原因是__________。
②由I、II中实验数据可证明A中产生的气体中含有HCl,则II中0.10mol·L-1AgNO3溶液的体积应大于__________mL(用含V的代数式表示)。
【答案】 ![]() MnO2+4H++2Cl-
MnO2+4H++2Cl- ![]() Cl2↑+2H2O+Mn2+ 溶液先变红再褪色 a、b Cl2+H2O
Cl2↑+2H2O+Mn2+ 溶液先变红再褪色 a、b Cl2+H2O![]() HCl+HClO,Cl2溶于水后使得溶液中的c(CI-)增大,也能析出晶体 生成1molHClO需消耗1molCl2,HClO也有氧化性,1molHClO和1molCl2均能将2molKI氧化成I2或者Cl2+H2O
HCl+HClO,Cl2溶于水后使得溶液中的c(CI-)增大,也能析出晶体 生成1molHClO需消耗1molCl2,HClO也有氧化性,1molHClO和1molCl2均能将2molKI氧化成I2或者Cl2+H2O![]() HCl+HClO,Cl2发生反应时,上述平衡逆向移动,相当于Cl2全部参与氧化I-的反应 0.4V
HCl+HClO,Cl2发生反应时,上述平衡逆向移动,相当于Cl2全部参与氧化I-的反应 0.4V
【解析】(1)Cl2的电子式是![]() ,二氧化锰与浓盐酸加热制备氯气的离子方程式为:MnO2+4H++2Cl-
,二氧化锰与浓盐酸加热制备氯气的离子方程式为:MnO2+4H++2Cl- ![]() Cl2↑+2H2O+Mn2+。(2)①因氯水既有酸性又强氧化性,能漂白有机色质,将氯气通入紫色蕊溶液中可以看到溶液先变红再褪色;②因浓盐酸有挥发性,将混有氯化氢的氯气通入硝酸银溶液,生成氯化银沉淀,其中氯离子可来自氯水或氯化氢中,故实验a、b均不能说明产生的气体中含有HCl;(3)氯气与水反应的平衡方程式为:Cl2+H2O
Cl2↑+2H2O+Mn2+。(2)①因氯水既有酸性又强氧化性,能漂白有机色质,将氯气通入紫色蕊溶液中可以看到溶液先变红再褪色;②因浓盐酸有挥发性,将混有氯化氢的氯气通入硝酸银溶液,生成氯化银沉淀,其中氯离子可来自氯水或氯化氢中,故实验a、b均不能说明产生的气体中含有HCl;(3)氯气与水反应的平衡方程式为:Cl2+H2O![]() HCl+HClO,Cl2溶于水后使得溶液中的c(Cl-)增大,也能析出晶体;(4)①生成1molHClO需消耗1molCl2,HClO也有氧化性,1molHClO和1molCl2均能将2molKI氧化成I2或者Cl2+H2O
HCl+HClO,Cl2溶于水后使得溶液中的c(Cl-)增大,也能析出晶体;(4)①生成1molHClO需消耗1molCl2,HClO也有氧化性,1molHClO和1molCl2均能将2molKI氧化成I2或者Cl2+H2O![]() HCl+HClO,Cl2发生反应时,上述平衡逆向移动,相当于Cl2全部参与氧化I-的反应;② 由关系式:Cl2——I2——2S2O32-——2Cl-;n(Cl-)=n(S2O32-)=n(AgNO3)= VmL×10-3×0.04mol·L-1,v(AgNO3)= n(AgNO3)/c(AgNO3)=( VmL×10-3×0.04mol·L-1/0.10mol·L-1)×103=0.4VmL。
HCl+HClO,Cl2发生反应时,上述平衡逆向移动,相当于Cl2全部参与氧化I-的反应;② 由关系式:Cl2——I2——2S2O32-——2Cl-;n(Cl-)=n(S2O32-)=n(AgNO3)= VmL×10-3×0.04mol·L-1,v(AgNO3)= n(AgNO3)/c(AgNO3)=( VmL×10-3×0.04mol·L-1/0.10mol·L-1)×103=0.4VmL。

 智慧小复习系列答案
智慧小复习系列答案