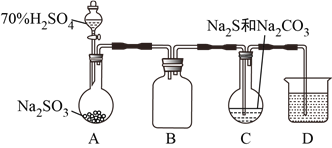
题目内容
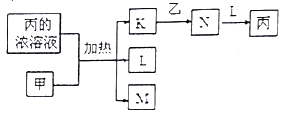
【题目】短周期主族元素W、X、Y、Z的原子序数依次增加。K、L、M、N均是由这些元素组成的二元化合物,甲、乙分别是元素X、Y的单质,甲是固体,乙是气体,K是主要的大气污染物之一,0.05mol·L-1丙溶液的pH为1,上述物质的转化关系如下图所示。下列说法正确的是( )
A. 原子半径:W<X<Y<Z B. 元素的非金属性:Y>Z>X
C. 原子最外层电子数:W<X<Y<Z D. K、L、M、N四种物质中沸点最高的是N
【答案】B
【解析】根据题意判断K、L、M、N分别是二氧化硫、水、二氧化碳、三氧化硫。W、X、Y、Z分别是氢、碳、氧、硫。A. 原子半径:X>Y,故A错误;B. 酸性:碳酸<硫酸,所以非金属性:碳<硫,同周期元素非金属性:氧>硫,因此,元素的非金属性:Y>Z>X,故B正确;C. 原子最外层电子数:W<X<Y=Z ,故C错误;D.水分子之间有氢键, K、L、M、N四种物质中沸点最高的是L,故D错误。故选B。

练习册系列答案
 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案
相关题目