题目内容
3.在一密闭容器中充入1molH2和1molⅠ2,压强为p(Pa),保持温度不变,使其发生反应:H2(g)+I2(g)?2HI(g).一段时间后达平衡,下列关于该平衡的说法正确的是( )| A. | 保持容器容积不变,向其中加入1molH2,平衡常数减小 | |
| B. | 保持容器容积不变,向其中加入1molHe,正逆反应速率均增大 | |
| C. | 保持容器内气体压强不变,向其中加入1molHe,反应速率均减小 | |
| D. | 保持容器内气体压强不变,再向其中加入1molH2和1molⅠ2,重新达平衡,H2的体积分数减小 |
分析 A、平衡常数只受温度的影响;
B、保持容器容积不变,向其中加入1molHe,各物质的浓度不变;
C、保持容器内气体压强不变,向其中加入1molHe,体积增加,所以浓度减小;
D、恒压加入1molH2和1molⅠ2浓度不变,平衡不移动.
解答 解:A、保持容器容积不变,向其中加入1molH2,平衡常数不变,故A错误;
B、保持容器容积不变,向其中加入1molHe,各物质的浓度不变,正逆反应速率均增不变,故B错误;
C、保持容器内气体压强不变,向其中加入1molHe,体积增加,所以浓度减小,反应速率均减小,故C正确;
D、保持容器内气体温度压强不变,向其中加入1 mol H2(g)和1molI2(g),因体积增大为2倍,物质的量增大为2倍,则浓度不变,平衡不移动,H2的体积分数不变,故D错误.
故选C.
点评 本题考查化学反应速率,侧重于影响因素的考查,难度中等,注意把握影响因素,易错点为B和C,注意惰性气体的特点.

练习册系列答案
 新题型全程检测期末冲刺100分系列答案
新题型全程检测期末冲刺100分系列答案
相关题目
9.H2有还原性,可以还原氧化铜,是因为H2中氢元素的化合价处于低价(0价),可以升高至+1价.由此分析:下列化学反应的反应物中的氢元素能体现还原性的是( )
| A. | Mg+2HCl═MgCl2+H2↑ | B. | 2Na2O2+2H2O═4NaOH+O2↑ | ||
| C. | NaH+H2O═NaOH+H2↑ | D. | 2H2O2═2H2O+O2↑ |
11.阱(N 2H4)常用于火箭或原电池的燃料.己知:
①N2(g)+2O2(g)=2NO2(g)△H=+67.7kJ/mol
②N2H4(g)+O2(g)=N2(g)+2H2O(g)△H=-534.0kJ•mol
③H2O(g)=H2O(1)△H=-44kJ/mol
(1)2N2H4(g)+2NO2(g)=3N2(g)+4H2O(1)△H=-1311.7kJ.mol-1
(2)一定温度下,将N2H4与N02以体积比1:1置于10L密闭容器中发生反应:2N2H4(g)+2NO2(g)=3N2(g)+4H2O(1)
下列不能说明反应达到平衡状态的是ac.(填序号)
a.混合气体密度保持不变 b.混合气体颜色保持不变
c.N2H4比与NO2体积比保持不变 d.体系压强保持不变
(3)在10L的密闭容器中发生上述反应,容器内部分物质的物质的量变化如下表:
前2min内NO2的平均反应速率为0.01mol/(L•min).平衡时N02的转化率25%;(2)中反应平衡常数表达式为K=$\frac{{c}^{3}({N}_{2})}{{c}^{2}({N}_{2}{H}_{4})•{c}^{2}(N{O}_{2})}$,计算该温度下反应的平衡常数K=0.9375.反应在第6min时改变了条件,改变的条件可能是bc(填序号)a.使用催化剂b.升高温度c.扩大容器容积d.增加N02的量
(4)若在一定温度下,(2)中反应的平衡常数为20,反应到某时刻测得N2H4、NO2、N2的溶度均为0.1mol.L-1,此时v正>v逆.
①N2(g)+2O2(g)=2NO2(g)△H=+67.7kJ/mol
②N2H4(g)+O2(g)=N2(g)+2H2O(g)△H=-534.0kJ•mol
③H2O(g)=H2O(1)△H=-44kJ/mol
(1)2N2H4(g)+2NO2(g)=3N2(g)+4H2O(1)△H=-1311.7kJ.mol-1
(2)一定温度下,将N2H4与N02以体积比1:1置于10L密闭容器中发生反应:2N2H4(g)+2NO2(g)=3N2(g)+4H2O(1)
下列不能说明反应达到平衡状态的是ac.(填序号)
a.混合气体密度保持不变 b.混合气体颜色保持不变
c.N2H4比与NO2体积比保持不变 d.体系压强保持不变
(3)在10L的密闭容器中发生上述反应,容器内部分物质的物质的量变化如下表:
| 物质的量/时间 | n(N2H4) | n(NO2) | n(N2) |
| 起始 | 0.8 | 1.6 | 0 |
| 第2min | 0.6 | a | 0.3 |
| 第5min | 0.4 | 1.2 | 0.6 |
| 第6min | 0.4 | 1.2 | 0.6 |
| 第10min | 0.6 | 1.4 | 0.3 |
(4)若在一定温度下,(2)中反应的平衡常数为20,反应到某时刻测得N2H4、NO2、N2的溶度均为0.1mol.L-1,此时v正>v逆.
8.化学工业与人类的生产生活息息相关,回答下列问题:
(1)已知反应:Fe(s)+CO2(g)?FeO(s)+CO(g)△H=a kJ?mol-1,平衡常数为K;
测得在不同温度下,K值如下:
①写出K的表达式$\frac{[CO]}{[CO2]}$.
②反应中的a大于0(填“大于”、“小于”或“等于”).
③若500℃时进行反应,CO2起始浓度为2mol?L-1,CO的平衡浓度为1mol?L-1.
④700℃反应达到平衡,此时增大反应中CO的浓度,该平衡移动后达到新的平衡,其它条件不变时,CO 和CO2的体积比值不变(填“增大”、“减小”或“不变”).
(2)工业固氮反应是:N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol.在相同温度下,体积均为0.25L的两个恒容密闭容器中可发生上述可逆反应,测得反应的有关数据如表:
①容器a达平衡时N2的平衡浓度c(N2)=3mol?L-1.
②容器b达平衡时NH3的平衡浓度c(NH3)=2mol?L-1.
③下列叙述正确的是AB.
A.容器a达平衡时NH3的物质的量是0.5mol
B.容器b开始是向合成氨的逆反应方向进行
C.若容器a体积变为0.2L,则达平衡时放出的热量小于23.1kJ
D.不能利用已知数据计算容器b的平衡常数.
(1)已知反应:Fe(s)+CO2(g)?FeO(s)+CO(g)△H=a kJ?mol-1,平衡常数为K;
测得在不同温度下,K值如下:
| 温度/℃ | 500 | 700 | 900 |
| K | 1.00 | 1.47 | 2.40 |
②反应中的a大于0(填“大于”、“小于”或“等于”).
③若500℃时进行反应,CO2起始浓度为2mol?L-1,CO的平衡浓度为1mol?L-1.
④700℃反应达到平衡,此时增大反应中CO的浓度,该平衡移动后达到新的平衡,其它条件不变时,CO 和CO2的体积比值不变(填“增大”、“减小”或“不变”).
(2)工业固氮反应是:N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol.在相同温度下,体积均为0.25L的两个恒容密闭容器中可发生上述可逆反应,测得反应的有关数据如表:
| 容器 编号 | 起始时各物质物质的量/mol | 达平衡时体系的 能量变化 | ||
| N2 | H2 | NH3 | ||
| a | 1 | 3 | 0 | 放热23.1kJ |
| b | 0.6 | 1.8 | 0.8 | 吸热Q kJ |
②容器b达平衡时NH3的平衡浓度c(NH3)=2mol?L-1.
③下列叙述正确的是AB.
A.容器a达平衡时NH3的物质的量是0.5mol
B.容器b开始是向合成氨的逆反应方向进行
C.若容器a体积变为0.2L,则达平衡时放出的热量小于23.1kJ
D.不能利用已知数据计算容器b的平衡常数.
12.在一定温度下,向不同电解质溶液中加入新物质时,其电流强度(I)随新物质加入量(m)的变化曲线不正确的是( )
| A. | 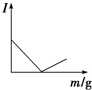 向Ba(OH)2溶液中逐滴加入等浓度的H2SO4至过量 | |
| B. | 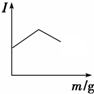 向醋酸溶液中逐滴加入等浓度的氨水至过量 | |
| C. | 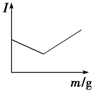 向盐酸溶液中逐滴加入等浓度的NaOH溶液至过量 | |
| D. | 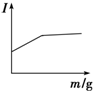 向氨水中逐滴加入等浓度的盐酸至过量 |
 .
.