题目内容
18.四氯化钛是工业制备金属钛的重要原料,制备四氯化钛的反应原理为:TiO2+2C+2Cl2$\frac{\underline{\;800℃\;}}{\;}$TiCl4+2CO;已知:
Ⅰ.常温下,四氯化钛是一种极易水解的无色液体,沸点为136.4℃.
Ⅱ.装置A中发生的化学反应为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O.
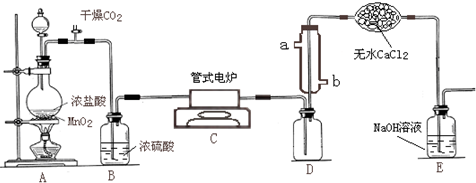
现用如图装置,模拟工业制备四氯化钛的生成过程,其主要操作步骤有:
①连接好整套装置,检查气密性;
②当D瓶中TiCl4的量不再增加时,停止加热,改通CO2气体直至电炉中瓷管冷却为止;
③将TiO2、碳粉混合装入管式电炉;其它所用药品也一并填装好;
④将电炉升温至800℃一段时间后,打开分液漏斗活塞并使浓盐酸与MnO2混合、关闭、并点燃酒精灯,同时在冷凝管中通冷凝水;
⑤先持续通入干燥的CO2气体一段时间,然后将其活塞关闭;
试回答下列问题:
(1)请写出CO2的电子式:
 .
.(2)正确的操作程序是(填写操作步骤的序号)①③⑤④②.
(3)操作⑤的目的是排尽装置内的空气,避免TiCl4遇空气中水蒸气发生水解.
(4)装置E的作用是吸收多余的Cl2及挥发的HCl,以免污染空气.
(5)少量TiCl4露置于潮湿空气中,可看到的现象是大量白雾产生,其化学方程式可表示为TiCl4+4H2O═4HCl+Ti(OH)4.
(6)指出该实验的不足、并改进尾气中含有毒气体CO,不能被NaOH溶液吸收;可在装置E后再连接一个燃烧或收集装置.
分析 装置A中用二氧化锰与浓盐酸加热生成氯气、二氧化锰和水,据此书写化学方程式;
(1)二氧化碳分子中碳原子最外层有4个电子,氧原子最外层有6个电子,碳原子与氧原子形成两对共用电子对,据此书写电子式;
(2)实验时,先装入药品,然后通入二氧化碳,将容器中的水蒸气、氧气等排除,加热反应,反应完毕后,继续通入二氧化碳,将装置内的氯气、CO等排出;
(3)四氯化钛极易水解,能与装置中的空气里的水蒸气反应;
(4)反应中有未反应的氯气及挥发出来的氯化氢,会污染空气,所以要用氢氧化钠溶液进行尾气吸收;
(5)TiCl4极易与空气中的水反应,会生成Ti(OH)4和氯化,氯化氢极易溶于水,与空气中的水结合形成雾状物质,根据元素守恒书写化学方程式;
(6)根据该实验的原理可知,C装置中产生CO,所以尾气中含有毒气体CO,不能被NaOH溶液吸收,会污染空气.
解答 解:装置A中用二氧化锰与浓盐酸加热生成氯气、二氧化锰和水,反应化学方程式为MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,
故答案为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;
(1)二氧化碳分子中碳原子最外层有4个电子,氧原子最外层有6个电子,碳原子与氧原子形成两对共用电子对,所以二氧化碳的电子式为 ,
,
故答案为: ;
;
(2)实验时,先装入药品,然后通入二氧化碳,将容器中的水蒸气、氧气等排除,加热反应,反应完毕后,继续通入二氧化碳,将装置内的氯气、CO等排出,操作顺序为①③⑤④②,
故答案为:①③⑤④②;
(3)四氯化钛极易水解,能与装置中的空气里的水蒸气反应,所以在通Cl2前先通入CO2气体并持续一段时间,排尽装置中的空气,避免TiCl4 遇空气中水蒸气发生水解,
故答案为:排尽装置内的空气,避免TiCl4 遇空气中水蒸气发生水解;
(4)反应中有未反应的氯气及挥发出来的氯化氢,会污染空气,所以要用氢氧化钠溶液进行尾气吸收,所以E的作用是吸收多余的Cl2及挥发的HCl,以免污染空气,
故答案为:吸收多余的Cl2及挥发的HCl,以免污染空气;
(5)TiCl4极易与空气中的水反应,会生成氯化氢,氯化氢极易溶于水,与空气中的水结合形成雾状物质,所以看到的现象是大量白雾产生,反应的化学方程式为:TiCl4+4H2O═4HCl+Ti(OH)4 ,
故答案为:大量白雾产生;TiCl4+4H2O═4HCl+Ti(OH)4 ;
(6)根据该实验的原理可知,C装置中产生CO,所以尾气中含有毒气体CO,不能被NaOH溶液吸收,会污染空气,为防止污染空气,可在装置E后再连接一个燃烧或收集装置,
故答案为:尾气中含有毒气体CO,不能被NaOH溶液吸收;可在装置E后再连接一个燃烧或收集装置.
点评 本题考查物质的制备和性质探究,为高频考点,侧重于学生的分析能力和实验能力的考查,要根据实验原理提出假设,再结合物质的性质加以验证,侧重于考查学生的实验探究能力和对知识的应用能力,题目难度中等.

| A. | 分子中有2个σ键和1个π键 | |
| B. | 可推测C=S键的键能大于745kJ•mol-1 | |
| C. | COS中碳原子是采用sp2杂化方式成键的 | |
| D. | 分解温度:CS2、COS、CO2依次由低到高 |
 高铁酸钾(K2FeO4)是一种高效多功能水处理剂,具有极强的氧化性.
高铁酸钾(K2FeO4)是一种高效多功能水处理剂,具有极强的氧化性.(1)已知:4FeO42-+10H2O?4Fe(OH)3+8OH-+3O2↑.K2FeO4在处理水的过程中所起的作用有K2FeO4具有强氧化性,能够消毒杀菌;同时FeO42-被还原成Fe3+,Fe3+水解形成Fe(OH)3胶体,能够吸附水中悬浮杂质.同浓度的高铁酸钾在pH为4.74、7.00、11.50的水溶液中最稳定的是pH=11.50的溶液.
(2)高铁酸钾有以下几种常见制备方法:
| 干法 | Fe2O3、KNO3、KOH混合加热共熔生成紫红色高铁酸盐和KNO2等产物 |
| 湿法 | 强碱性介质中,Fe(NO3)3与NaClO反应生成紫红色高铁酸盐溶液 |
| 电解法 | 制备中间产物NaFeO,再与KOH溶液反应 |
②湿法制备中,若Fe(NO3)3加入过量,在碱性介质中K2FeO4与Fe3+发生氧化还原反应生成K3FeO4,此反应的离子方程式:2FeO42-+Fe3++8OH-=3FeO43-+4H2O.
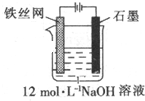
③制备中间产物Na2FeO4,可采用的装置如图所示,则阳极的电极反应式为Fe+8OH--6e-═FeO42-+4H2O.
(3)比亚迪双模电动汽车使用高铁电池供电,其总反应为:
3Zn+2K2FeO4+8H2O$?_{充电}^{放电}$3Zn(OH)2+2Fe(OH)3+4KOH
放电时负极材料为Zn,正极反应为:FeO42-+4H2O+3e-═Fe(OH)3+5OH-.
(4)25℃时,CaFeO4的Ksp=4.54×l0-9,若要使1000L,含有2.0×l0-4 mol•L-lK2FeO4的废水中的c(FeO42-)有沉淀产生,理论上至少加入Ca(OH)2的物质的量为2.27×10-2mol.
| A. | 保持容器容积不变,向其中加入1molH2,平衡常数减小 | |
| B. | 保持容器容积不变,向其中加入1molHe,正逆反应速率均增大 | |
| C. | 保持容器内气体压强不变,向其中加入1molHe,反应速率均减小 | |
| D. | 保持容器内气体压强不变,再向其中加入1molH2和1molⅠ2,重新达平衡,H2的体积分数减小 |
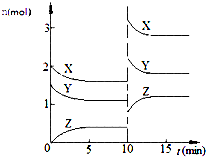
| A. | 反应方程式中n=2 | |
| B. | 该反应的△S>0 | |
| C. | 10 min时,曲线发生变化的原因是增大压强 | |
| D. | 0~5min内,平均反应速率v(X)=0.04 mol•L-1•min-1 |
| A. | ②⑤④③①⑥ | B. | ④①②⑤③⑥ | C. | ④②①③⑤⑥ | D. | ⑤②④①③⑥ |
 某同学配制98mL 3.0mol•L-1 NaOH溶液的实验步骤如下:
某同学配制98mL 3.0mol•L-1 NaOH溶液的实验步骤如下: