题目内容
11.30%的H2SO4和50%的H2SO4等质量混合后,所得溶液的质量分数等于(填“大于”“小于”或“等于”)40%;如果是等体积混合,混合以后所得溶液溶质的质量分数大于(填“大于”“小于”或“等于”)40%.分析 设硫酸溶液的质量为m,表示出不同浓度硫酸中溶质的质量,二者之和为混合后溶液中溶质质量,混合后溶液的质量为2m,进而计算混合后的溶质的质量分数;
设体积分别为VmL,30%的H2SO4溶液密度为ρ1,50%的H2SO4溶液密度为ρ2,表示出混合后溶液中溶质质量分数,硫酸的浓度越大密度越大,结合表达式判断质量分数关系.
解答 解:设硫酸溶液的质量为m,30%的H2SO4溶质为质量0.3m,50%的H2SO4溶质的质量为0.5m,混合后总质量为2m,所以w(H2SO4)=$\frac{0.3m+0.5m}{2m}$=40%,
如果等体积混合,设体积分别为VmL,30%的H2SO4溶液密度为ρ1,50%的H2SO4溶液密度为ρ2,则混合后溶液的质量分数为w(H2SO4)=$\frac{V{ρ}_{1}×30%+V{ρ}_{2}×50%}{V{ρ}_{1}+V{ρ}_{2}}$=30%+20%×$\frac{{ρ}_{2}}{{ρ}_{1}+{ρ}_{2}}$,因硫酸的浓度越大,密度越大,则ρ1<ρ2,则$\frac{{ρ}_{2}}{{ρ}_{1}+{ρ}_{2}}$>$\frac{1}{2}$,故30%+20%×$\frac{{ρ}_{2}}{{ρ}_{1}+{ρ}_{2}}$>40%,
故答案为:等于;大于.
点评 本题侧重考查学生分析计算能力,难度中等,注意对公式的理解与应用,注意硫酸的浓度越大密度越大.

练习册系列答案
相关题目
19.在海水的综合利用中,海水提溴工业是一个重要组成部分,其中一种提溴的工艺是在预先浓缩并酸化的海水中,通入足量氯气,然后使生成的溴与吸收剂SO2反应转化为氢溴酸以达到富集溴元素的目的.有关上述工艺流程的以下化学用语中,不正确的是( )
| A. | SO2吸收溴单质时发生反应的化学方程式为:2H2O+SO2+Br2═H2SO3+2HBr | |
| B. | 海水中通入氯气时发生反应的离子方程式为:2Br-+Cl2═Br2+2Cl- | |
| C. | Cl-的结构示意图为: | |
| D. | 海水中Br-的电子式为: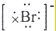 |
16.水的电离过程为2H2O(l)?H3O+(aq)+OH-(aq),在两种不同温度点时的离子积分别为K(25℃)=1.0×10-14、K(100℃)=5.5×10-13.则下列叙述中正确的是( )
| A. | 纯水的电离度α(25℃)>α(100℃) | |
| B. | 水电离时其热效应是△H>0的过程 | |
| C. | 纯水中的c(H+)随着温度的降低而增大 | |
| D. | 在100℃时,纯水依然呈中性,则c(H+)=c(OH-)=1.0×10-7mol•L-1 |
3.为了除去氯化铝酸性溶液中的Fe3+,可在加热搅拌的条件下加入一种过量的试剂,过滤后再加入适量盐酸.这种试剂是( )
| A. | 氨水 | B. | 氧化铝 | C. | 氢氧化钠 | D. | 氢氧化铁 |
20.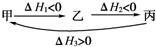 假设反应体系的始态为甲,中间态为乙,终态为丙,它们之间的变化用下图表示,则下列说法不正确的是( )
假设反应体系的始态为甲,中间态为乙,终态为丙,它们之间的变化用下图表示,则下列说法不正确的是( )
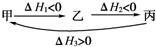 假设反应体系的始态为甲,中间态为乙,终态为丙,它们之间的变化用下图表示,则下列说法不正确的是( )
假设反应体系的始态为甲,中间态为乙,终态为丙,它们之间的变化用下图表示,则下列说法不正确的是( )| A. | |△H1|>|△H2| | B. | |△H1|<|△H3| | ||
| C. | △H1+△H2+△H3=0 | D. | 甲-→丙的△H=△H1+△H2 |
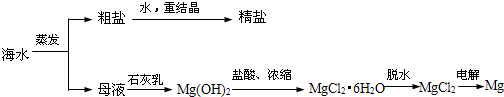
 ;
; (R1、R2代表烃基或氩原子)
(R1、R2代表烃基或氩原子)
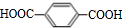 .
. +O2$→_{△}^{Cu}$2
+O2$→_{△}^{Cu}$2 +2H2O;反应⑦的化学方程式为
+2H2O;反应⑦的化学方程式为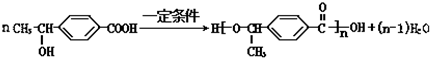 .
.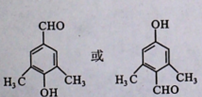 .
.