题目内容
19.在海水的综合利用中,海水提溴工业是一个重要组成部分,其中一种提溴的工艺是在预先浓缩并酸化的海水中,通入足量氯气,然后使生成的溴与吸收剂SO2反应转化为氢溴酸以达到富集溴元素的目的.有关上述工艺流程的以下化学用语中,不正确的是( )| A. | SO2吸收溴单质时发生反应的化学方程式为:2H2O+SO2+Br2═H2SO3+2HBr | |
| B. | 海水中通入氯气时发生反应的离子方程式为:2Br-+Cl2═Br2+2Cl- | |
| C. | Cl-的结构示意图为: | |
| D. | 海水中Br-的电子式为: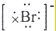 |
分析 A.溴具有强氧化性,能和二氧化硫发生氧化还原反应;
B.氯气和溴离子能发生置换反应;
C.氯离子核外有3个电子层,最外层有8个电子;
D.阴离子的电子式要用[]把电子和元素符合括起来.
解答 解:A.溴具有强氧化性,二氧化硫具有还原性,二氧化硫和溴、水能发生氧化还原反应生成氢溴酸和硫酸,反应方程式为:2H2O+SO2+Br2=H2SO4+2HBr,故A错误;
B.氯气和溴离子能发生置换反应生成溴和氯离子,离子反应方程式为:2Br-+Cl2=Br2+2Cl-,故B正确;
C.氯离子核外有3个电子层,最外层有8个电子,其离子结构示意图为: ,故C正确;
,故C正确;
D.阴离子的电子式要用[]把电子和元素符合括起来,溴离子最外层有8个电子,其电子式为: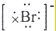 ,故D正确;
,故D正确;
故选A.
点评 本题考查较综合,涉及氧化还原反应、原子结构示意图、电子式的书写等知识点,注意溴、氯气都能氧化二氧化硫,题目较简单.

练习册系列答案
 学期复习一本通学习总动员期末加暑假延边人民出版社系列答案
学期复习一本通学习总动员期末加暑假延边人民出版社系列答案 芒果教辅暑假天地重庆出版社系列答案
芒果教辅暑假天地重庆出版社系列答案
相关题目
10.下列化学试剂的保存不正确的是( )
| A. | 金属钠保存煤油中 | B. | 浓硝酸存放于棕色试剂瓶中 | ||
| C. | 白磷保存在水中 | D. | NaOH溶液用玻璃塞密封保存 |
7.下列说法错误的是( )
| A. | 石油的分馏和裂化都是物理变化 | |
| B. | 煤的干馏和液化都是化学变化 | |
| C. | 乙烯通过加聚反应得到聚乙烯 | |
| D. | 含硫化石燃料的大量燃烧造成了酸雨 |
14.某MCFC型塑料电池可同时供应电和水蒸气,其工作温度为600℃-700℃,所用燃料为氢气,电解质为熔融的K2CO3.该电池的总反应式为:2H2+O2=2H2O,负极反应为:H2+CO32--2e-=H2O+CO2.则下列推断中,正确的是( )
| A. | 通入氢气的一极为电池的正极 | |
| B. | 当电池中生成1 mol水时,转移4 mol电子 | |
| C. | 正极反应为4OH--4e-=2H2O+O2↑ | |
| D. | 放电时CO32-向负极移动 |
4.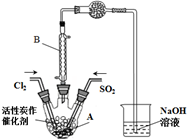 某学习小组依据反应:SO2(g)+Cl2(g)?SO2Cl2(g)△H<0,设计制备磺酰氯(SO2Cl2)的装置如图,有关信息如右表所示.
某学习小组依据反应:SO2(g)+Cl2(g)?SO2Cl2(g)△H<0,设计制备磺酰氯(SO2Cl2)的装置如图,有关信息如右表所示.
(1)若用浓盐酸与二氧化锰为原料制取Cl2,反应的化学方程式为MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O.
(2)B仪器的作用是防止水蒸气进入A装置(引起SO2Cl2水解).
(3)为了便于混合物的分离且提高反应物的转化率,A装置的反应条件最好选择a.
a.冰水浴 b.常温 c.加热至69.1℃
(4)如果通入的Cl2或SO2含有水蒸气,氯气和二氧化硫可能发生反应的化学方程式为SO2+Cl2+2H2O=H2SO4+2HCl.
(5)实验时先通入干燥的Cl2将A装置中的空气赶走,再缓慢通入干燥的SO2,即发生反应.充分反应后,继续通入Cl2使装置中的SO2进入烧杯中被吸收.分离产物后,向获得的SO2Cl2中加水,出现白雾,振荡、静置得到无色溶液W.
①经分析SO2Cl2与H2O反应属于非氧化还原反应,写出该反应的化学方程式.
②无色溶液W中的阴离子除含少量OH-外,还含有其它两种阴离子,检验溶液W中这两种阴离子方法是取少量W溶液于试管中,加入过量Ba(NO3)2溶液,有不溶于稀硝酸的白色沉淀产生,说明溶液中含有SO42-.
③反应完成后,在W溶液、烧杯中分别滴加过量的BaCl2溶液,均出现白色沉淀,此沉淀不溶于稀盐酸,经过滤、洗涤、干燥,称量得到的固体质量分别为Xg、Yg.
计算SO2+Cl2?SO2Cl2反应中,SO2的转化率(用含X、Y的代数式表示).
 某学习小组依据反应:SO2(g)+Cl2(g)?SO2Cl2(g)△H<0,设计制备磺酰氯(SO2Cl2)的装置如图,有关信息如右表所示.
某学习小组依据反应:SO2(g)+Cl2(g)?SO2Cl2(g)△H<0,设计制备磺酰氯(SO2Cl2)的装置如图,有关信息如右表所示.| SO2Cl2 | Cl2 | SO2 | |
| 熔点/℃ | -54.1 | -101 | -72.4 |
| 沸点/℃ | 69.1 | -34.6 | -10 |
| 性质 | 遇水发生 剧烈水解 |
(2)B仪器的作用是防止水蒸气进入A装置(引起SO2Cl2水解).
(3)为了便于混合物的分离且提高反应物的转化率,A装置的反应条件最好选择a.
a.冰水浴 b.常温 c.加热至69.1℃
(4)如果通入的Cl2或SO2含有水蒸气,氯气和二氧化硫可能发生反应的化学方程式为SO2+Cl2+2H2O=H2SO4+2HCl.
(5)实验时先通入干燥的Cl2将A装置中的空气赶走,再缓慢通入干燥的SO2,即发生反应.充分反应后,继续通入Cl2使装置中的SO2进入烧杯中被吸收.分离产物后,向获得的SO2Cl2中加水,出现白雾,振荡、静置得到无色溶液W.
①经分析SO2Cl2与H2O反应属于非氧化还原反应,写出该反应的化学方程式.
②无色溶液W中的阴离子除含少量OH-外,还含有其它两种阴离子,检验溶液W中这两种阴离子方法是取少量W溶液于试管中,加入过量Ba(NO3)2溶液,有不溶于稀硝酸的白色沉淀产生,说明溶液中含有SO42-.
③反应完成后,在W溶液、烧杯中分别滴加过量的BaCl2溶液,均出现白色沉淀,此沉淀不溶于稀盐酸,经过滤、洗涤、干燥,称量得到的固体质量分别为Xg、Yg.
计算SO2+Cl2?SO2Cl2反应中,SO2的转化率(用含X、Y的代数式表示).
 实验室利用饱和NaNO2溶液(12mol/L)和NH4Cl溶液加热制备N2.
实验室利用饱和NaNO2溶液(12mol/L)和NH4Cl溶液加热制备N2.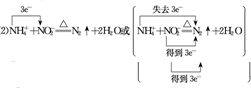
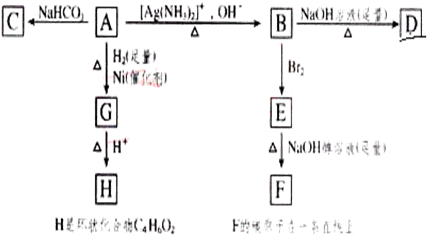
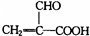 .
.