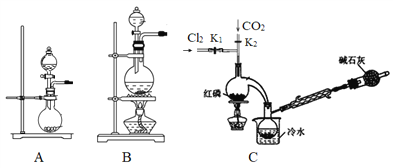
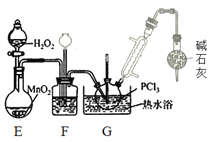
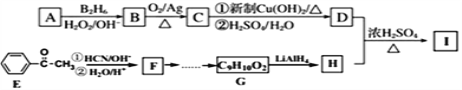
题目内容
【题目】某同学利用氧化还原反应:2KMnO4+10FeSO4+8H2SO4=2MnSO4+5Fe2(SO4)3+K2SO4 +8H2O设计如下原电池,盐桥中装有饱和KCl溶液。下列说法正确的是

A. b电极上发生还原反应
B. 外电路电子的流向是从a到b
C. 电池工作时,盐桥中的SO42-移向甲烧杯
D. a电极上发生的反应为:MnO4-+8H++5e- = Mn2++4H2O
【答案】D
【解析】试题分析:A、根据原电池的工作原理:负极失电子,发生氧化反应,正极得电子发生还原反应,b极上电极反应式:Fe2+-e-=Fe3+,A错误;B、外电路电子流向是从b流向a,B错误;C、根据原电池的工作原理:阴离子向负极移动,阳离子向正极移动,SO42-向b极移动,C错误;D、总电极反应式:2MnO4-+10Fe2++16H+=2Mn2++10Fe3++8H2O,a极是正极得电子,电极反应式=总电极反应式-b极反应式,得出:2MnO4-+16H++10e-=2Mn2++8H2O,化简得:MnO4-+8H++5e-=Mn2++4H2O,D正确;答案选D。

 名校课堂系列答案
名校课堂系列答案【题目】TiCl4是由钛精矿(主要成分为TiO2)制备钛(Ti)的重要中间产物,制备纯TiCl4的流程示意图如下:
![]()
资料:TiCl4及所含杂质氯化物的性质
化合物 | SiCl4 | TiCl4 | AlCl3 | FeCl3 | MgCl2 |
沸点/℃ | 58 | 136 | 181(升华) | 316 | 1412 |
熔点/℃ | 69 | 25 | 193 | 304 | 714 |
在TiCl4中的溶解性 | 互溶 | —— | 微溶 | 难溶 | |
(1)氯化过程:TiO2与Cl2难以直接反应,加碳生成CO和CO2可使反应得以进行。
已知:TiO2(s)+2 Cl2(g)= TiCl4(g)+ O2(g) ΔH1=+175.4 kJ·mol-1
2C(s)+O2(g)=2CO(g) ΔH2=-220.9 kJ·mol-1
① 沸腾炉中加碳氯化生成TiCl4(g)和CO(g)的热化学方程式:____________________。
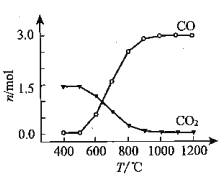
② 氯化过程中CO和CO2可以相互转化,根据如图判断:CO2生成CO反应的ΔH_____0(填“>”“<”或“=”),判断依据:_______________。
③ 氯化反应的尾气须处理后排放,尾气中的HCl和Cl2经吸收可得粗盐酸、FeCl3溶液,则尾气的吸收液依次是__________________________。
④ 氯化产物冷却至室温,经过滤得到粗TiCl4混合液,则滤渣中含有_____________。
(2)精制过程:粗TiCl4经两步蒸馏得纯TiCl4。示意图如下:
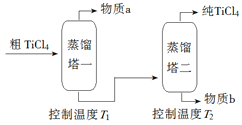
物质a是______________,T2应控制在_________。