题目内容
【题目】三氯氧磷(POCl3)是一种工业化工原料。无色透明的带刺激性臭味的液体,在潮湿空气中剧烈发烟。某化学小组采用PCl3氧化法制备POCl3。已知:POCl3的熔点为-112℃,沸点为75.5℃。在潮湿空气中二者均极易水解面剧烈“发烟”。回答下列问题:
I.制备PCl3
(1)实验室用高锰酸钾和浓盐酸反应制取氯气。发生装置可以选择图中的_____(填字母代号)。
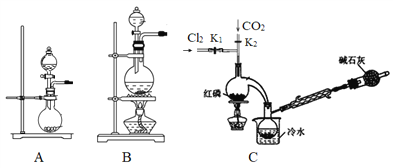
(2)检查装置气密性并装入药品后,先关闭K1,打开K2通入干燥的CO2,一段时间后,关闭K2,加热曲颈瓶同时打开K1通入干燥氯气,反应立即进行。通干燥CO2的作用是_______。
II.制备POCl3(如图)
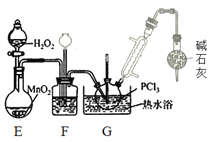
(3)盛放碱石灰的仪器的作用是________,装置G中发生反应的化学方程式为________ 。
(4)装置F的作用除观察O2的流速之外,还有________。
III.测定POCl3含量
实验制得的POCl3中常含有PCl3杂质,通过下面方法可测定产品的纯度:
①快速称取5.000g产品,加水反应后配成250mL溶液;
②取以上溶液25.00mL,向其中加入10.00mL0.1000mol/L碘水(足量),充分反应;
③向②所得溶液中加入几滴淀粉溶液,用0.1000mol/L的Na2S2O3溶液滴定;
④重复②、③操作,平均消耗0.1000mol/LNa2S2O3溶液8.00mL.
已知:H3PO3+I2+H2O==H3PO4+2HI,I2+2Na2S2O3==2NaI+Na2S4O6.
(5)滴定终点的现象为__________。该产品的纯度为________。
(6)若滴定管在滴定前无气泡,滴定后有气泡,则测定结果______(填“偏高”“偏低”或“不变”)。
【答案】 【答题空10-1】A 防止红磷被氧气氧化和生成的 PCl3与空气中的 O2和水反应 隔离空气中的水蒸气,防止水解 2PCl3+O2=2POCl3 平衡气压、干燥氧气 当最后一滴标准液滴入时,溶液由蓝色变为无色,且半分钟内不变色 83.5% 偏低
【解析】分析:本题是一道和制备相关的实验题,涉及实验装置的选择;实验操作的分析;仪器中药品的作用;装置的作用;纯度计算;误差分析。
详解:I.(1)实验室用高锰酸钾和浓盐酸反应制备氯气,发生:2MnO4-+10Cl-+16H+=2Mn2++5Cl2↑+8H2O,反应不需要加热,故选A;
(2)由于红磷易被氧化和PCl3易被氧化和水解,反应前通干燥CO2排除装置中的空气,防止红磷被氧气氧化和生成的 PCl3与空气中的 O2和水反应,本题答案为:防止红磷被氧气氧化和生成的 PCl3与空气中的 O2和水反应。
II. (3) 为防止外界水蒸气进入G使PCl3水解,干燥管中盛放碱石灰,装置G中发生PCl3被氧化成POCl3的反应,化学方程式为2PCl3+O2=2POCl3 ;本题答案为:隔离空气中的水蒸气,防止水解;2PCl3+O2=2POCl3 。
(4)装置F中的长颈漏斗,可以平衡压强,起到安全瓶的作用,所以装置F的作用除观察O2的流速之外,还有平衡气压、干燥氧气;本题答案为:平衡气压、干燥氧气。
III. (5)依据反应原理,滴定终点的现象为当最后一滴标准液滴入时,溶液由蓝色变为无色,且半分钟内不变色;
关系式:PCl3![]() H3PO3
H3PO3 ![]() I2,I2
I2,I2![]() 2Na2S2O3;
2Na2S2O3;
消耗Na2S2O3的物质的量=0.1000mol/L×8.00×10-3L=8×10-4mol,
和Na2S2O3反应的I2的物质的量=![]() ×8×10-4mol=4×10-4mol,
×8×10-4mol=4×10-4mol,
PCl3的物质的量=和PCl3反应的I2的物质的量=0.1000mol/L×10.00×10-3L-4×10-4mol=6×10-4mol,
PCl3的质量=6×10-4mol×137.5g/mol=8.25×10-2g,
样品中含PCl3的质量=8.25×10-2g×![]() =0.825g,样品纯度=
=0.825g,样品纯度=![]() ×100%=83.5%;
×100%=83.5%;
(6)若滴定管在滴定前无气泡,滴定后有气泡,则消耗Na2S2O3溶液的体积偏小,导致计算出的PCl3的质量偏大,测定结果则偏低。

 名校课堂系列答案
名校课堂系列答案【题目】碳捕集封存作为减少温室气体排放的一种手段,受到许多国家的重视,将捕获的二氧化碳转化为可用产品将促进这技术的推广使用。
I.某校科研小组的同学设计用氢氧化钠溶液来“捕捉”二氧化碳,其基本过程如图装置(部分条件及物质末标出)。

(1)在整个“捕捉”过程中,将NaOH溶液喷成雾状是为了___________,可以循环利用的物质是___________ 。
(2)一定条件下,不同物质的量的CO2与不同体积的1.0mol/LNaOH溶液充分反应放出的热量如下表所示:
反应序号 | CO2的物质的量/mol | NaOH溶液的体积/L | 放出的热量/kJ |
1 | 0.5 | 0.75 | a |
2 | 1.0 | 2.00 | b |
该条件下CO2与NaOH溶液反应生成NaHCO3溶液的热化学方程式为____________ 。
(3)下列溶液中,同样能用于“捕捉”二氧化碳的是________(填序号)。
A.KNO3溶液 B.CaCl2溶液 C.CuSO4溶液 D.Na2CO3溶液
II.在海洋碳循环中,通过如图所示的途径固碳。

(1)写出钙化作用的离子方程式:______________。
(2)利用如图所示装置从海水中提取CO2,有利于减少环境温室气体含量。

①结合方程式简述提取CO2的原理:________________。
②用该装置产生的物质处理b室排出的海水,合格后排回大海。处理至合格的方法是_____________。